PRIMA FACOLTA' DI MEDICINA E CHIRURGIA - CLM "B"
SAPIENZA UNIVERSITA' DI ROMA
I lipidi (chiamati anche grassi) sono composti di origine biologica, eterogenei dal punto di vista chimico, che condividono la caratteristica di essere scarsamente solubili in acqua. Di conseguenza, posti in soluzione acquosa, tendono a separarsi e formare una fase propria come accade ad esempio se si mescolano acqua e olio.
I lipidi possono essere raggruppati in classi chimicamente piu' omogenee:
1) Cere (esteri di acidi carbossilici a lunga catena idrocarburica con alcoli a lunga catena idrocarburica; spesso l'acido e l'alcol hanno lo stesso numero di acidi di carbonio)
2) Gliceridi e fosfogliceridi (esteri del glicerolo)
3) Colesterolo e suoi derivati
4) Derivati della sfingosina, che includono anche i glicosidi e i cerebrosidi ("glicolipidi").
Gli acidi grassi sono acidi carbossilici di alcani, alcheni o polieni con 10-20 atomi di carbonio. In genere il numero totale degli atomi di carbonio e' pari perche' la biosintesi di questi composti e' effettuata unendo tra loro molecole a due atomi di carbonio. Esempi di acidi grassi sono:
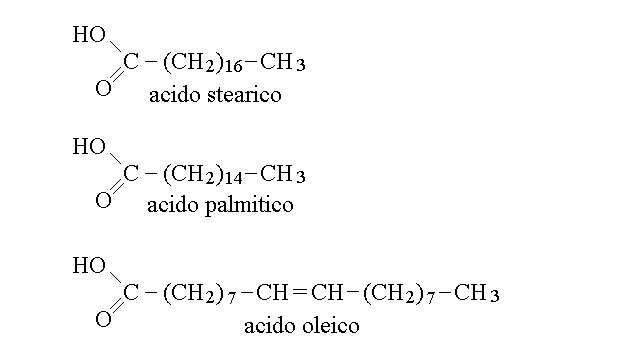
Gli acidi grassi si comportano in acqua come acidi deboli poco solubili, e dissociano reversibilmente come dall'esempio seguente, con valori di Ka prossimi a 10-5 M:
CH3-(CH2)7-CH=CH-(CH2)7-COOH + H2O <==> CH3-(CH2)7-CH=CH-(CH2)7-COO- + H3O+
I sali degli acidi grassi (in genere ottenuti mediante titolazione con basi forti o idrolisi basica dei trigliceridi) sono chiamati saponi. Ad esempio la formula del sapone palmitato di sodio e': CH3-(CH2)14-COONa.
Essendo elettroliti forti (come qualunque altro sale) i saponi in acqua sono dissociati negli ioni costituenti (e danno una modesta idrolisi basica). Una caratteristica dei saponi e' la capacita' di formare in acqua degli aggregati sferici chiamati micelle, nei quali la parte idrofobica della molecola e' sequestrata all'interno della sferula mentre verso l'esterno viene rivolto il gruppo carbossilico ionizzato, polare e capace di interagire con l'acqua.
I gliceridi sono esteri del glicerolo (propantriolo; e' il prodotto di riduzione del diidrossiacetone) con acidi grassi. Se una molecola di glicerolo forma un legame estere con un solo acido grasso il prodotto si chiama monogliceride; se forma due legami estere con due acidi grassi si ha un digliceride; ed infine se forma tre legami estere con tre acidi grassi si ha un trigliceride:
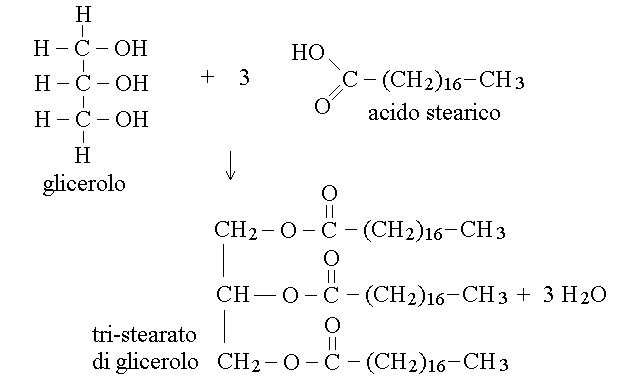
I trigliceridi sono molto comuni nel nostro organismo (la gran parte delle nostre riserve energetiche, contenute nel tessuto adiposo e' costituita da trigliceridi) e negli alimenti (sono prevalentemente costituiti da trigliceridi l'olio, il burro e i grassi animali). I digliceridi e i monogliceridi sono intermedi nella biosintesi e nella degradazione (digestione) dei trigliceridi, ma non sono molto rappresentati nel nostro organismo.
Quando gli acidi grassi dei trigliceridi sono saturi, le molecole si impaccano strettamente tra loro e la sostanza e' solida a temperatura ambiente (ad es. il burro); quando invece una parte consistente degli acidi grassi e' costituita da molecole insature o poliinsature, la sostanza e' liquida a temperatura ambiente (ad es. olio).
I fosfogliceridi sono derivati dell'acido fosfatidico un derivato del glicerolo nel quale i primi due gruppi ossidrilici dell'alcol sono esterificati con due acidi grassi, e il terzo con acido fosforico. I fosfogliceridi presentano un secondo alcol a sua volta esterificato con il residuo fosforico dell'acido fosfatidico; ne e' un esempio la fosfatidil-etanolamina:
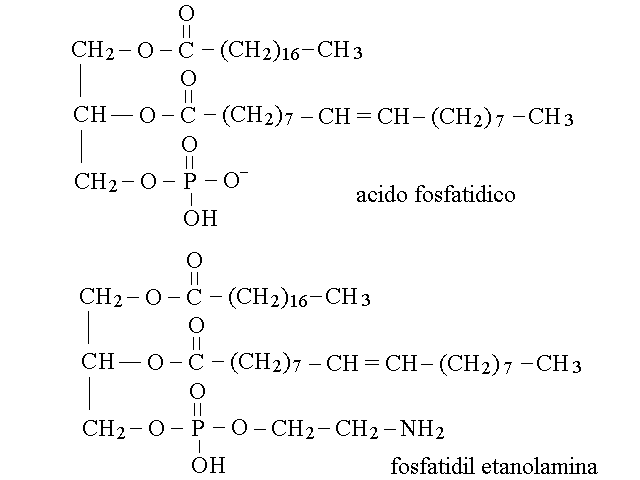
L'idrolisi dei fosfogliceridi restituisce quattro componenti: glicerolo, acidi grassi, acido fosforico e il "quarto componente" (che sopra e' stato chiamato secondo alcol). I principali quarti componenti dei fosfogliceridi biologici sono tre aminoalcoli (2-etanolamina, serina e colina) e l'inositolo.
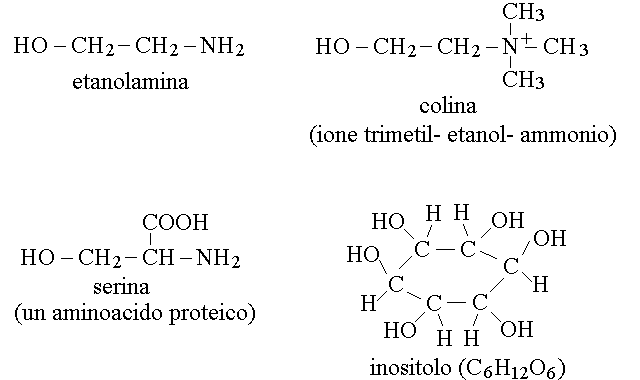
MEMBRANE LIPIDICHE
Le cellule sono rivestite da membrane costituite da un doppio strato di fosfolipidi, nel quale sono immerse proteine. Il principale tipo di fosfolipidi delle membrane biologiche e' rappresentato dai fosfogliceridi, contenenti sia acidi grassi saturi che insaturi, e tutti i tipi di quarti componenti. Il motivo per il quale i fosfolipidi formano le membrane a doppio strato e' connesso con il fatto che essi presentano una "testa" polare che interagisce con l'acqua (il gruppo fosfato - quarto componente) e due "code" apolari (le catene idrocarburiche degli acidi grassi) che invece interagiscono tra loro:
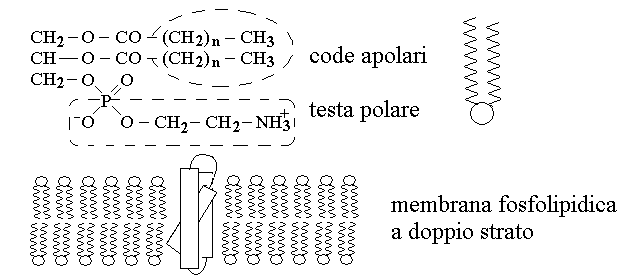
Il colesterolo ed i suoi derivati sono globalmente chiamati steroidi; tutti condividono una struttura comune. Nel nostro organismo il colesterolo e' sintetizzato per primo e ciascuno dei suoi derivati e' sintetizzato a partire da lui. Il colesterolo e' un alcol policiclico non aromatico la cui struttura deriva da una molecola, non presente nell'organismo, chiamata ciclopentano-peridrofenantrene:
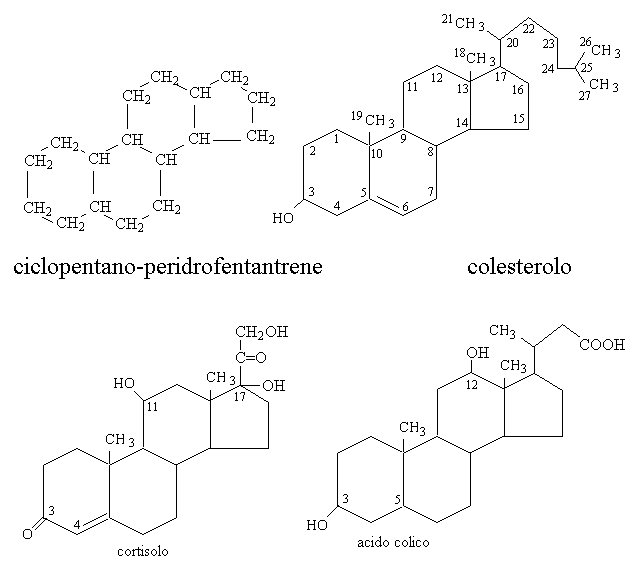
Il colesterolo, oltre ad essere il precursore di tutti gli steroidi, e' presente come tale o nella forma dei suoi esteri nelle membrane cellulari insieme ai fosfolipidi, e' conservato nel tessuto adiposo ed e' trasportato agli altri tessuti dalle lipoproteine del sangue.
I principali derivati del colesterolo appartengono a due classi molto diverse tra loro per struttura e funzioni:
1) Gli ormoni steroidei, a loro volta classificati come glicocorticoidi (cortisolo, cortisone, etc.); mineralcorticoidi (aldosterone); e ormoni sessuali (maschili: testosterone, androstenedione, etc.; femminili: estrogeni, progesterone). Tutti gli ormoni steroidei sono prodotti dalla corticale del surrene, ma nel caso degli steroidi sessuali la sede principale di produzione e' rappresentata dalle gonadi (ovaio e testicolo).
2) I sali o acidi biliari, prodotti dal fegato (ad es. l'acido colico), che hanno la funzione di emulsionare e rendere digeribili i lipidi introdotti con l'alimentazione.
La sfingosina e' un aminoalcol a 18 atomi di carbonio. Il prodotto della reazione tra la sfingosina e un acido grasso e' chiamato ceramide (il nome deriva dal legame carboamidico che unisce i due composti). La ceramide assomiglia per struttura ad un digliceride. Ne' la sfingosina ne' la ceramide si trovano da soli nel nostro organismo; pero' la ceramide (come i digliceridi) puo' coniugarsi con un acido fosforico e quest'ultimo con un quarto componente; il prodotto finale e' un fosfolipide diverso dai fosfogliceridi, chiamato sfingomielina. Le formule ed i confronti tra le strutture nominate sono cosi' rappresentati:
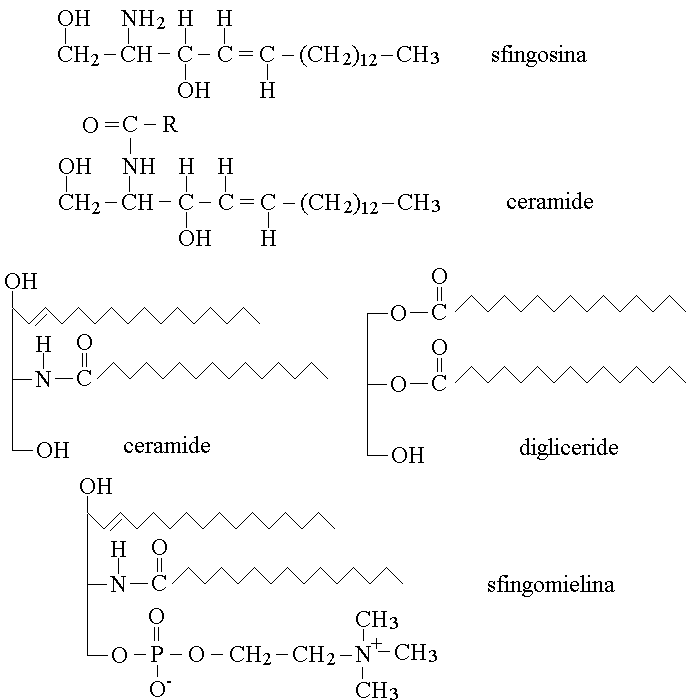
La sfingomielina partecipa alla costituzione delle membrane cellulari comportandosi esattamente come un fosfogliceride, ed e' un componente importante di alcune membrane molto particolari come quelle dei neuroni e della glia (guaine mieliniche).
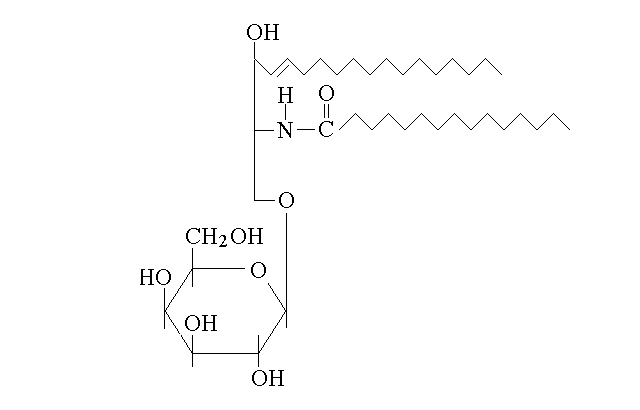
Un altro tipo di derivati della ceramide ha importanza in biologia e medicina: i glicosfingolipidi (gangliosidi e cerebrosidi). In questi lipidi molto particolari, che partecipano anch'essi alla costituzione delle membrane dei neuroni e della glia, il gruppo semiacetalico di uno zucchero (o quello terminale di un piccolo polisaccaride) forma un legame di tipo acetalico (glicosidico) con il gruppo alcolico libero della ceramide:
Gli aminoacidi presentano un gruppo carbossilico, un gruppo aminico e un residuo legati ad un carbonio centrale, asimmetrico, chiamato Cα. Sono composti molto importanti, che svolgono varie funzioni nell'organismo, la principale delle quali e' l'essere i monomeri delle proteine, eteropolimeri lineari orientati molto importanti in biologia. Gli aminoacidi che costituiscono le proteine (aminoacidi "proteici") sono tutti stereoisomeri L sul Cα e sono 20, differenti per il residuo R.
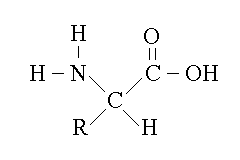
I residui R dei 20 aminoacidi proteici sono:
1) alifatici:
glicina (Gly, G): R = H
alanina (Ala, A): R = CH3
valina (Val, V): R = CH(CH3)2
leucina (Leu, L): R = CH2-CH(CH3)2
isoleucina (Ile, I): R = CH(CH3)-CH2-CH3
2) polari:
serina (Ser, S): CH2OH
cisteina (Cys, C): CH2SH
treonina (Thr, T): CHOH-CH3
metionina (Met, M): CH2-CH2-S-CH3
3) la prolina e' l'unico iminoacido e viene riportato per intero anziche' col solo residuo R (vedi figura)
4) aromatici:
fenilalanina (Phe, F; vedi figura)
tirosina (Tyr, Y; vedi figura)
triptofano (Trp, W; vedi figura)

5) basici:
istidina (His, H; vedi figura)
lisina (Lys, K): (CH2)4 - NH2
arginina (Arg, R; vedi figura)
6) acidi (dicarbossilici):
acido aspartico (Asp, D): CH2-COOH
acido glutamico (Glu, E): CH2-CH2-COOH
7) amidici:
asparagina (Asn, N): CH2-CONH2
glutamina (Gln, Q): CH2-CH2-CONH2
TITOLAZIONE DEGLI AMINOACIDI. Il gruppo α-aminico di ogni aminoacido si titola come una base debole ed il gruppo α-carbossilico come un acido debole; possono inoltre essere presenti eventuali altri gruppi titolabili nel residuo R (aminacidi basici e acidi; tirosina). Per effettuare la titolazione occorre partire da una specie completamente acidificata, come ad esempio il sale cloruro della forma aminica protonata: Cl- NH3+-CαHR-COOH e aggiungere piccole aliquote di base a concentrazione nota:

REAZIONI DEGLI AMINOACIDI.
1) Transaminazione con un α-chetoacido (scambio dei gruppi aminico e chetonico). E' la reazione catalizzata dagli enzimi chiamati transaminasi, normalmente contenuti all'interno delle cellule (specialmente del fegato; in corso di malattie di quest'organo la morte delle cellule rilascia le transaminasi nel sangue, dove vengono dosate). Ad esempio la Glutamico-Piruvico Transaminasi (GPT, ALT) catalizza la seguente reazione reversibile:
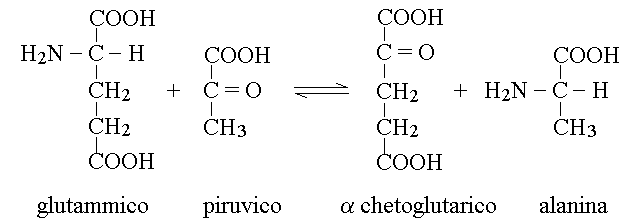
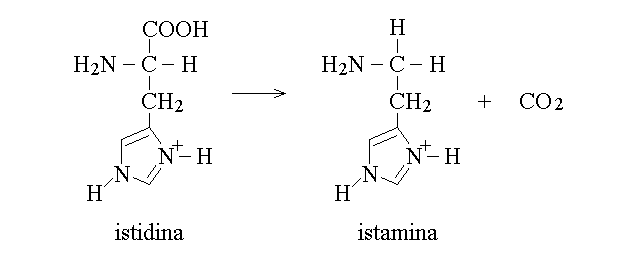
2) Decarbossilazione: restituisce anidride carbonica e l'amina corrispondente all'aminoacido; e' catalizzata dalle decarbossilasi. Alcune delle amine ottenute in questa reazione hanno attivita' di mediatori o ormoni. Ad esempio:
AMINOACIDI NON PROTEICI. Alcuni amnoacidi non presenti nelle proteine hanno grande rilievo in biologia e in medicina. Ad esempio la D-alanina e' un componente del peptidoglicano che costituisce il rivestimento di molti batteri, mentre la L-ornigtina e' un intermedio metabolico della biosintesi dell'urea.
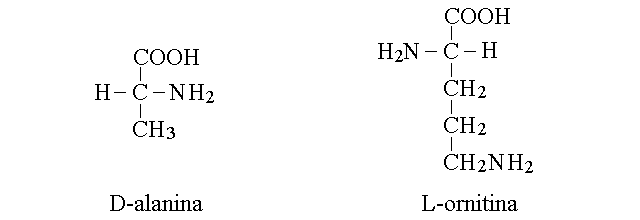
I polimeri degli aminoacidi si formano grazie al legame peptidico, un caso particolare del legame carboamidico (cosi' chiamato perche' simile al gruppo amidico):
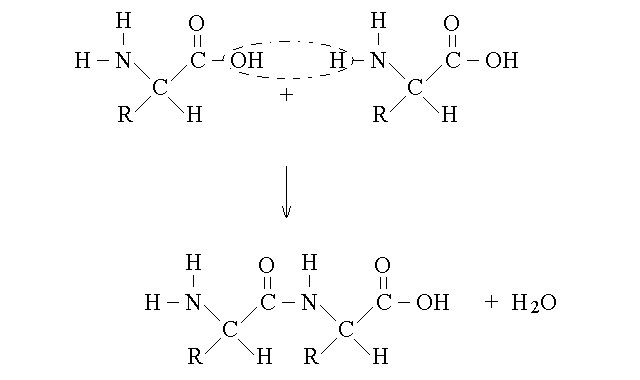
Il legame peptidico si instaura tra il carbonio del gruppo α carbossilico del primo aminoacido e l'azoto del gruppo α aminico del secondo aminoacido, con eliminazione di una molecola d'acqua. Per capire bene la struttura e le proprieta' di questo legame importantissimo in biologia, occorre fare le seguenti osservazioni:
1) il carbonio e l'azoto coinvolti nel legame peptidico presentano entrambi l'ibridazione sp2 e la geometria trigonale planare.
2) Come conseguenza del precedente punto 1, il carbonio, l'azoto, gli atomi legati al carbonio (Cα e O) e quelli legati all'azoto (Cα e H) giacciono tutti sullo stesso piano.
3) C'e' delocalizzazione del doppio legame tra l'ossigeno, il carbonio e l'azoto; questo conferisce al legame peptidico un parziale carattere di doppio legame (come del resto avviene nelle amidi):
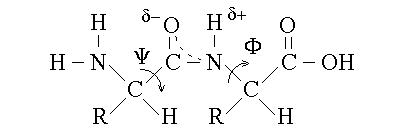
4) A causa della parziale natura di doppio legame del legame peptidico, non e' ammessa la rotazione del CO e dell'NH ed il legame peptidico presenta gli isomeri geometrici cis e trans (quest'ultimo e' preferito per il minore ingombro sterico che deriva dall'allontanare tra loro il Cα legato al CO e il Cα legato all'NH).
5) E' permessa la rotazione del Cα rispetto al CO e del Cα rispetto all'NH, con gli angoli di legame denominati rispettivamente psi e fi.
POLIPEPTIDI E PROTEINE. I polipeptidi sono i polimeri degli aminoacidi. Sono eteropolimeri, perche' la sequenza dei residui e' libera; sono lineari (non ramificati) ed orientati, perche' hanno una estremita' con il gruppo aminico libero ed una con il gruppo carbossilico libero:
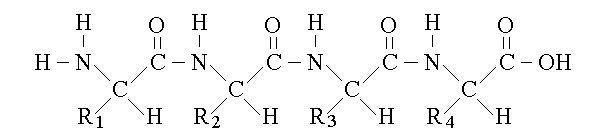
Le proteine sono polipeptidi di grandi dimensioni (da 100 ad oltre 1000 residui aminoacidici) con peso molecolare superiore a 10.000 UMA. La loro sequenza aminoacidica e' determinata dai geni contenuti nel DNA della cellula.
STRUTTURA DELLE PROTEINE. Le proteine presentano una struttura complessa, descritta secondo quattro livelli di organizzazione ordinati gerarchicamente:
1) la struttura primaria e' data dalla sequenza degli aminoacidi, a partire dall'estremita' amino-terminale della catena polipeptidica. E' sostanzialmente un elenco di aminoacidi come ad es. NH2-Val-...-Arg-COOH.
2) La struttura secondaria e' dovuta al ripiegamento su se stessa della catena polipeptidica causato dallo stabilirsi di legami idrogeno tra i gruppi NH e CO dei legami peptidici. Puo' essere periodica, nelle forme a spirale (detta α-elica) e del foglietto β (fatto di segmenti lineari contrapposti), oppure non periodica (ripiegamento casuale).
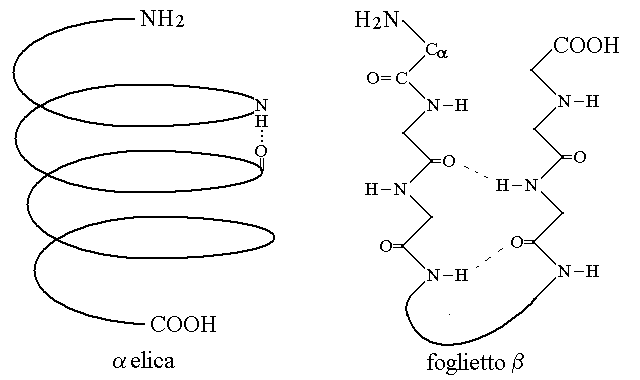
L'α-elica e' una spirale che presenta circa 3,4 residui aminoacidici per giro; il foglietto β si forma se tratti diversi della catena polipeptidica si dispongono gli uni di fronte agli altri in senso parallelo o antiparallelo (come in figura). In entrambi i casi, le strutture periodiche richiedono angoli di rotazione fi e psi costanti per i tratti della catena polipeptidica interessati. Le strutture periodiche sono entro certi limiti indipendenti dalla sequenza aminacidica perche' tutti gli aminoacidi possiedono i gruppi CO e NH necessari per formarle. Esistono pero' eccezioni perche' alcuni aminoacidi o sequenze di aminoacidi non formano i legami fi e psi necessari (ad es. la prolina interrompe le α-eliche).
3) la struttura terziaria e' data dal ripiegarsi su se stessi di segmenti a struttura secondaria periodica e da alla macromolecola la sua forma che puo' essere fibrosa (allungata) o globulare (approssimativamente sferica). I legami chimici che mantengono le strutture terziari sono a carico del residuo R degli aminoacidi e pertanto le strutture terziarie, al contrario delle secondarie sono fortemente dipendenti dalle sequenze aminoacidiche; essi sono: (a) interazioni di Van der Waals tra i residui aminoacidici apolari che si separano spontaneamente dal solvente acquoso rifugiandosi all'interno della macromolecola; (b) i legami idrogeno e i legami ionici tra residui aminoadicici distanti; (c) legami disolfuro tra residui di cisteina:
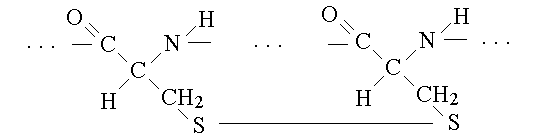
4) la struttura quaternaria e' data dall'eventuale aggregazione di piu' catene polipeptidiche. Alcune proteine sono costituite da una sola catena polipeptidica (ad es. l'albumina del sangue), altre da piu' di una legate insieme dagli stessi legami responsabili del mantenimento della struttura terziaria (ad es. le immunoglobuline).
DENATURAZIONE DELLE PROTEINE. Si chiama nativa la struttura secondaria e terziaria (e quaternaria se c'e') normalmente presente nelle condizioni fisiologiche e capace delle funzioni biologiche caratteristiche della proteina in questione. Nella gran parte dei casi, le proteine vengono preparate dai tessuti biologici nella loro struttura nativa. Tutte le proteine, pero', possono essere poste in condizioni sperimentali nelle quali la struttura terziaria, e in alcuni casi anche secondaria, vengono perdute. Questo processo si chiama denaturazione. In molte proteine la denaturazione e' un processo reversibile e se la proteina denaturata viene posta in condizioni sperimentali adeguate essa spontaneamente riacquista la sua struttura nativa (rinaturazione). Gli esperimenti di denaturazione-rinaturazione dimostrano che la struttura secondaria e terziaria delle proteine sono interamente determinate dalla struttura primaria e suggeriscono che la configurazione nativa corrisponda ad un minimo termodinamico dell'energia delle interazioni degli aminoacidi tra loro e col solvente.
Le procedure comunemente impiegate per denaturare le proteine sono: il riscaldamento, la variazione del pH, l'uso di solventi organici o l'aggiunta di soluti perturbatori della struttura dell'acqua (urea, guanidina). In genere la differenza energetica tra la configurazione nativa e le configurazioni denaturate (che sono tra loro isomeri conformazionali e geometrici) e' piccola e corrisponde a poche kcal/mole
Gli acidi nucleici (desossiribonucleico, DNA e ribonucleico, RNA), che conservano e trasmettono l'informazione genetica, sono eteropolimeri lineari orientati di nucleotidi.
NUCLEOTIDI. I nucleotidi sono molecole complesse costituite da uno zucchero (il ribosio oppure il 2-desossiribosio), una base azotata deivata dalla purina oppure dalla pirimidina, e una molecola di acido fosforico:
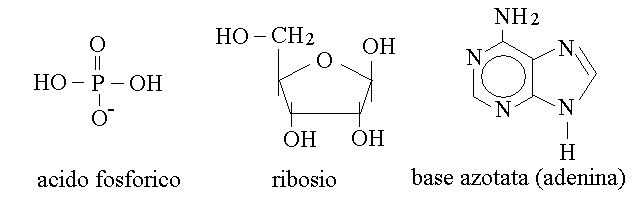
RIBOSIO E DESOSSIRIBOSIO. Il ribosio e' un aldopentoso che in soluzione forma una struttura ciclica semiacetalica a cinque atomi di tipo furanosico; il 2-desossiribosio e' un derivato del ribosio.
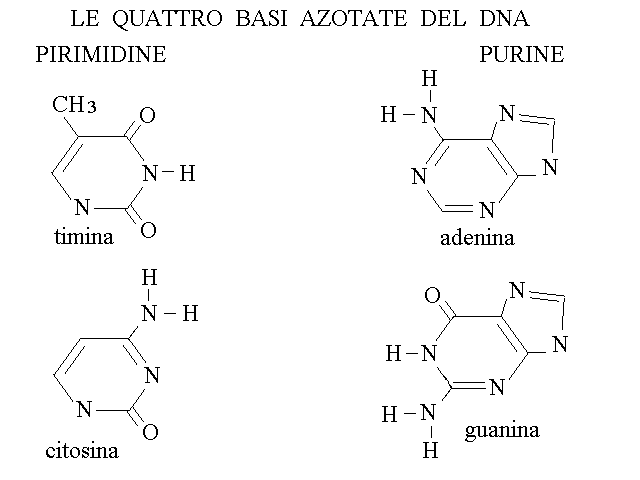
LE BASI AZOTATE. Le basi azotate del DNA e dello RNA sono eterociclici a carattere aromatico, e dal punto di vista chimico si possono considerare derivati della purina o della pirimidina (si vedano le formule di questi composti nella lezione sulla chimica organica). E' importante sottolineare che dal punto di vista biochimico, la biosintesi delle basi azotate non passa attraverso la purina e la pirimidina; la classificazione chimica non ha quindi rapporto con l'origine biologica di questi composti.
Nel DNA si trovano quattro basi azotate: due purine (adenina, A, e guanina, G) e due pirimidine (timina, T, e citosina, C). Nello RNA si trovano quattro basi azotate delle quali tre sono identiche a quelle del DNA (adenina, guanina e citosina) mentre la quarta e' leggermente diversa (uracile, U, al posto della timina; la differenza tra queste due e' la sostituzione di un idrogeno dell'uracile con un gruppo metilico nella timina che risulta quindi essere metil-uracile).
STRUTTURA DEI NUCLEOTIDI. Le tre molecole che costituiscono il nucleotide si legano tra loro in questo modo: l'acido fosforico forma un legame di tipo estere con l'ossidrile in posizione 5 del ribosio o del desossiribosio; la base azotata forma un legame di tipo N-glicosidico con il carbonio semiacetalico dello zucchero:
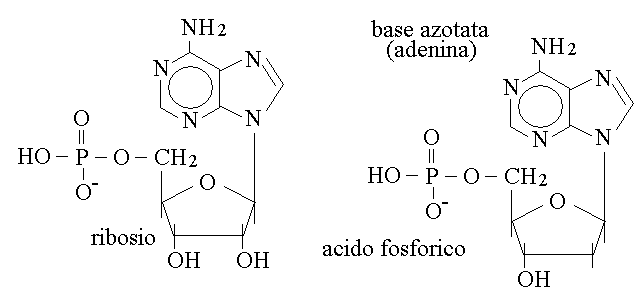
Come si vede in figura, la differenza tra il ribonucleotide (a sinistra) e il desossiribonucleotide (a destra) e' limitata alla presenza o assenza dell'ossidrile in posizione 2 sullo zucchero, che non partecipa al legame con l'acido fosforico ne' con la base azotata.
Per non confondere nella descrizione della molecola gli atomi di carbonio della base azotata con quelli dello zucchero si adotta la seguente convenzione: con la notazione C1,C2, etc. ci si riferisce alla base azotata mentre con C1',C2', etc. ci si riferisce allo zucchero. E' quindi corretto dire che l'acido fosforico si lega alla posizione C5' dello zucchero e la base alla C1' (leggi C5 primo, C1 primo).
LEGAME FOSFODIESTERE. Il polimero dei nucleotidi si forma mediante lo stabilirsi di un legame fosfodiestere tra l'acido fosforico legato ad un nucleotide e l'ossidrile in posizione C3' del nucleotide successivo (e di nuovo non viene utilizzata la posizione C2': questo significa che il legame e' analogo nel DNA e nello RNA):
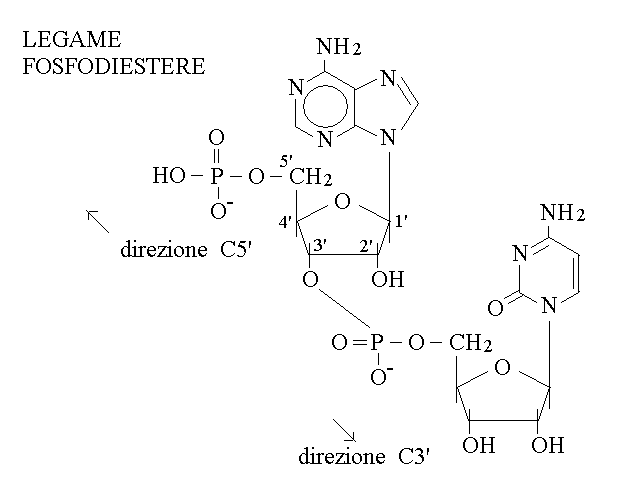
Il polimero di nucleotidi (spesso chiamato un "filamento") presenta le seguenti caratteristiche:
1) ha uno scheletro lineare formato dalla sequenza ribosio-fosfato-ribosio, che non ammette ramificazioni;
2) e' orientato (ha una estremita' col C5' libero ed una col C3' libero);
3) e' un eteropolimero (le basi azotate non parecipano allo scheletro e la loro sequenza e' libera).
ACCOPPIAMENTO DELLE BASI AZOTATE. Le basi azotate possono accoppiarsi tra loro mediante legami idrogeno in due sole coppie: A con T (e la sua inversa, T con A; nello RNA A con U e U con A) e G con C (e la sua inversa, C con G). La limitazione degli accoppiamenti possibili e' dovuta ai seguenti fattori:
1) quando i polimeri si appaiano per lunghi tratti le coppie devono essere purina-pirimidina: la coppia purina-purina e' troppo grande, la coppia pirimidina-pirimidina troppo piccola rispetto alla siatnza tra i due polimeri appaiati.
2) La coppia AT forma due legami idrogeno e la coppia GC ne forma tre.
3) La polarita' dei legami idrogeno in posizione corrispondente nelle due coppie e' inversa. Questo si osserva molto bene in figura: ad esempio T presenta un gruppo accettore dell'idrogeno, cioe' un CO, in corrispondenza di un gruppo donatore su A, cioe' NH2; l'altra purina (G) non potrebbe formare questo legame perche' nella posizione corrispondente G presenta un gruppo accettore di idrogeno (CO). Ragionamenti analoghi si possono fare per tutti gli altri legami idrogeno.
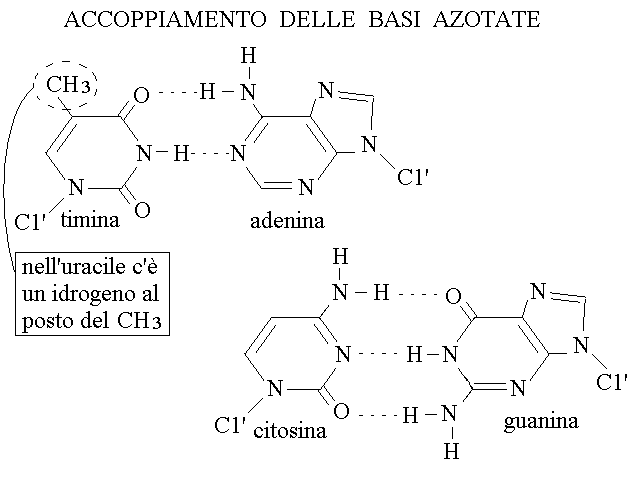
4) la coppia AU nello RNA e' sostanzialmente analoga alla coppia AT nel DNA perche' la sola differeza tra U e T (assenza o presenza di un gruppo metilico) occorre in una posizione che non interferisce con i legami idrogeno responsabili dell'appaiamento.
STRUTTURA E REPLICAZIONE DEL DNA. Il DNA si trova nei cromosomi delle cellule eucariote o nel citoplasma delle cellule procariote ed ha la struttura di due polimeri tra loro appaiati per via dei legami idrogeno tra le rispettive basi azotate. I due polimeri o filamenti sono allineati in senso antiparallelo (cioe' la polarita' C3'-C5' del secondo e' inversa a quella del primo). Questa disposizione consente a ciascuno dei due filamenti di potersi comportare come un "stampo per la biosintesi dell'altro: cioe' la sequenza nucleotidica di ciascuno e' anequivocamente indicata da quella, complementare e antiparallela, dell'altro:
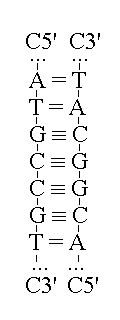
La duplicazione del DNA richiede la separazione dei due filamenti e la polimerizzazione di nucleotidi trifosfati, con formazione del legame fosfodiestere ed eliminazione di una molecola di acido pirofosforico (H4P2O7) per ogni legame formato. La reazione e' catalizzata dall'enziam DNA polimerasi, che aggiunge all'estremita' C3' della catena polinucleotidica neoformata un nucleotide C5' trifosfato; pertanto la biosintesi del DNA procede nella direzione C3' -> C5'. La DNA polimerasi non sa in quale sequenza devono essere disposti i nucleotidi: prende questa informazione da uno dei due filamenti, utilizzato come "stampo", e ne sintetizza uno complementare e antiparallelo. La DNA polimerasi umana e' un enzima molto preciso, che commette meno di un errore per ogni milione di nucleotidi aggiunti. L'errore della DNA polimerasi costituisce una mutazione.
Esiste inoltre un altro enzima, la RNA polimerasi, che forma catene polinucleotidiche di RNA utilizzando come stampo un filamento di DNA. Questo processo si chiama trascrizione e consente di esportare l'informazione genetica al di fuori del nucleo per la sintesi proteica.
Perche' gli acidi nucleici sono le molecole prescelte dalla selezione naturale per mantenere e trasmettere l'informazione genetica? Gli acidi nucleici possiedono duee proprieta' molto peculiari e adatte per questi scopi:
1) sono eteropolimeri lineari a sequenza libera. Un omopolimero non potrebbe portare nessuna informazione.
2) L'accoppiamento delle basi azotate e' fondamentale per la duplicazione del DNA e quindi per la replicazione cellulare; e' molto importante quindi che gli accoppiamenti esistano e che siano molto rigorosi (e' un vantaggio che le coppie siano soltanto due perche' questo riduce il rischio di errori della DNA polimerasi).
TAUTOMERIA CHETO-ENOLICA DELLE BASI AZOTATE. Alcune delle basi azotate dello RNA o del DNA possono andare incontro a fenomeni di tautomeria cheto-enolica e presentarsi quindi, occasionalmente, nella meno comune forma enolica. Questo fenomeno, che e' una reazione chimica e avviene per ciascuna molecola indipendendemente da ogni altra, e' particolarmente rilevante nel caso del DNA perche' se interviene nel corso della sua replicazione puo' alterare gli accoppiamenti delle basi ed essere causa di mutazione. Il caso piu' evidente e' quello della timina, il cui tautomero chetonico si accoppia con l'adenina, mentre quello enolico si accoppia con la guanina:

Domande (la risposta e' obbligatoria se e' stata attivata la registrazione elettronica della presenza)
1) I monosaccaridi sono:
poliidrossialdeidi o poliidrossichetoni
acidi carbossilici con una lunga catena carboniosa
molecole che possiedono il gruppo carbossilico e il gruppo aminico
2) Una proteina e' un eteropolimero di aminoacidi legati tra loro con legame:
acetalico
estere
peptidico
3) Le sfingomieline sono composte da:
sfingosina, acido grasso, acido fosforico, quarto componente
ceramide, acido fosforico
sfingosina, acido fosforico, quarto componente
4) L'acido gluconico deriva dal glucosio per ossidazione del
C6
C1
C6 e C1
Il tuo punteggio: 0
La tua presenza non e' stata registrata perche' il sistema non e' attivo o non hai inserito il numero di matricola.
Puoi inserire le tue domande o commenti nello spazio qui sotto (lunghezza massima = 160 caratteri):
Buonasera Professore ho 2 domande:
1 Nel funzionamento della PET lei ci ha detto che il radiofarmaco utilizzato il glucosio marcato
con l'isotopo 19 del Fluoro mentre su questo sito c'e' scritto che l'isotopo utilizzato il Fluoro 18.
2 Come mai la cinetica radioattiva ha andamento discontinuo??
1 Ha ragione il sito, mi devo essere sbagliato, l'emettitore beta meno e' 18F.
2 La cinetica radioattiva e' una funzione probabilistica: ogni atomo ha una certa probabilita' di
trasformarsi nell'unita' di tempo. Se la quantita' degli atomi e' sufficientemente piccola e'
possibile seguire i singoli eventi di decadimento. Tra un evento e l'altro non accade nulla.
L'esponenziale e' l'integrale di questa funzione probabilistica.
Non ho capito bene l'ibridazione
L'ibridazione e' il fenomeno per cui due orbitali atomici che hanno una
parziale sovrapposizione possono cambiare forma e produrre due orbitali ibridi con minore
sovrapposizione. Consegue all'interazione tra le funzioni d'onda degli elettroni, e al fatto che
gli elettroni essendo carichi negativamente tendono a respingersi tra loro: gli orbitali ibridi
minimizzano le aree di sovrapposizione reciproca, allontanando tra loro gli elettroni di
orbitali diversi.
Scusi professore la differenza di intensita' del campo elettromagnetico per
ogni nucleo e' dovuta al diverso numero di particelle oppure ad altro?
Ogni nucleo genera attorno a se un campo elettrostatico la cui intensita'
dipende dalla sua carica, cioe' dal numero di protoni.
Ho una domanda non ho capito esattamente qual e' la differenza tra nuclear spin
e nuclear momento? E' diverso da zero solo quando il numero di protoni e neutroni e' ...?
C'e' una buona spiegazione della risonanza magnetica nucleare su
questo sito.
In pratica ogni particella nucleare ha il suo spin (rotazione sul suo asse) e lo spin vale
+1/2 o -1/2
1) Se i protoni e i neutroni sono entrambi pari, allora il nucleo ha spin zero.
2) Se i protoni e i neutroni sono gli uni pari e gli altri dispari, allora il nucleo ha spin
semi-intero (1/2, 3/2, 5/2, ...).
3) Se i protoni e i neutroni sono entrambi dispari, allora il nucleo ha spin intero (1, 2, 3, ...)
Tutti i nuclei con spin diverso da zero sono osservabili all'NMR, ciascuno e' eccitabile con
la sua frequenza caratteristica.
Il momento magnetico e' il vettore campo magnetico generato dallo spin.
Non ho capito bene l'orbitale anti-sigma
La sovrapposizione di due orbitali atomici forma due orbitali di legame:
uno con la massima densita' elettronica nella zona di massima sovrapposizione tra i due
orbitali atomici (orbitale di legame sigma) e uno con la massima densita' elettronica nelle
regioni nelle quali non vi e' sovrapposizione (orbitale anti-sigma). Perche' il legame sia stabile
e' necessario che l'orbitale sigma, a minima energia, sia popolato da due elettroni e l'orbitale
anti-sigma non sia popolato da elettroni. Aggiungero' una figura per illustrare questo
concetto nel testo della lezione sul sito.
Non ho capito la differenza tra uno ione e un (atomo) radicale
Uno ione e' un atomo (o una molecola nel caso degli ioni poliatomici) che
ha perduto o acquistato uno o piu' elettroni. Uno ione monoatomico e' stabile se acquisisce
la configurazione elettronica del gas nobile piu' vicino nella tavola periodica. Ad esempio lo
ione sodio ha la configurazione elettronica perde un elettrone per raggiungere la stessa
configurazione elettronica del gas nobile che precede il sodio (il neon), mentre il fluoro
ottiene lo stesso risultato acquistando un elettrone e trasformandosi nello ione fluoruro.
Na+, Ne e F- hanno la stessa configurazione elettronica:
1s2 2s2 2p6.
Un radicale e' un atomo o una molecola che possiede uno o piu' elettroni spaiati. Ad esempio
l'atomo di sodio ha la configurazione elettronica 1s2 2s2 2p6 3s1
ed e' quindi un radicale se considerato in forma isolata; quando perde un elettrone e si
trasforma nello ione sodio, ha tutti elettroni appaiati e non e' quindi piu' un radicale.
Poiche' le specie chimniche con elettroni spaiati sono instabili i radicali stabili sono pochi.
Un radicale stabile interessante e' l'ossido nitrico, NO che possiede in tutto 15 elettroni ed
ha quindi un elettrone spaiato.
Buonasera professore ho qualche dubbio sulle considerazioni energetiche:
Se non ho capito male l'entalpia e' la misura dell'energia potenziale di interazione tra le
molecole; quando e' che questa risulta minima?
Inoltre non ho capito se l'una puo' prevalere sull'altra per quanto riguarda la stabilita' del
sistema o se trattandosi di due contributi diversi non sia possibile confrontarle grazie mille.
Non sono sicuro di aver capito bene le domande. L'entalpia e' l'energia
intesa nel senso comune del termine; ad esempio l'energia di legame. Quando due atomi si
legano tra loro e si forma il legame, l'energia di legame e' energia emessa dalla molecola
sotto forma di calore (cioe' la molecola ha minore energia degli atomi isolati). Entalpia e' per
questo motivo e in questo contesto chiamata anche il calore di reazione e si misura in cal/mole.
L'entropia e' invece la probabilita' di un certo stato del sistema e puo' essere misurata in
cal/grado.mole grazie alla legge di Boltzmann. Se nella sua domanda l'una e' l'entalpia e
l'altra e' l'entropia, la risposta e' si, si possono sommare algebricamente e la loro differenza
da l'energia libera del sistema. Di norma noi parliamo in questo contesto di trasformazioni
(ad esempio di reazioni chimiche) e abbiamo: ΔG = ΔH - TΔS, dove ΔG: variazione di
energia libera tra gli stati finale e iniziale del sistema, ΔH: variazione di entalpia,
ΔS: variazione di entropia, T: temperatura assoluta in gradi Kelvin.
Buongiorno Professore non ho capito bene la frazione molare
La frazione molare del componente i-esimo della miscela (che si indica
con Xi) e' data dal rapporto tra il numero di moli del componente i-esimo e la somma delle
moli di ciascun componente: Xi = ni / (ni + nj + ... + nz).
Non ho capito quali sono i microstati.
Un sistema termodinamico presenta un macrostato, che e', ad esempio, il suo stato di
aggregazione. Supponiamo che il macrostato del sistema sia gassoso o liquido. Lo stesso stato puo'
corrispondere a molte disposizioni diverse delle stesse molecole: le molecole di un liquido o di un gas
si muovono le une rispetto alle altre. Ogni possibile disposizione delle molecole nello spazio corrisponde
a un microstato del sistema. Ovviamente i microstati di un sistema anche piccolo sono estremamente
numerosi.
Buonasera professore non sono riuscito a risolvere il primo quesito delle soluzioni.
E' la conversione tra due unita' di misura della concentrazione. Prova a
calcolare come prima cosa quanti grammi di saccarosio e quanti grammi di acqua sono
presenti in una certa quantita' di soluzione. La quantita' su cui ragionare puoi sceglierla tu
perche' il risultato finale sara' lo stesso qualunque sia la quantita' scelta (ad es. 1 L).
Buonasera professore potrebbe definire il pH degli acidi deboli e cosa intendiamo con A- e_HA
Non e' possibile rispondere a una domanda come questa in questo
spazio: la spiegazione del pH e di cosa sono gli acidi e le basi deboli e' data nelle dispense
e occupa un certo spazio e varie figure, non puo' essere riscritta qui. Studi bene il materiale
presentato al link https://www.andreabellelli.it/html/didattica/generale/pH.php.
Con A- e HA intendiamo rispettivamente lo ione derivante dalla dissociazione
dell'acido debole e l'acido debole indissociato; ad esempio CH3-COO- e CH3-COOH.
Perche' le concentrazioni utilizzate sono 045 NaCl accompagnata da 5
glucosio o 0,22 NaCl e 5 glucosio e mai 0,9 %NaCl se proprio questa ha uguale p osm del sangue?
Dove ha trovato i dati citati? Le soluzioni 0,9% (peso/volume) di NaCl e
5% (peso/volume) di glucosio sono soluzioni isotoniche col sangue e sono usate entrambe
per le infusioni endovenose. Qualunque miscela di queste e' isotonica e puo' essere usata allo
stesso scopo. Esistono molte decine di soluzioni isotoniche con composizioni diverse, che
possono essere usate.
Non ho capito qual è la differenza tra una reazione endoergonica e una endotermica
Endotermica o esotermica si riferisce al calore di reazione (il delta H) e,
eventualmente al lavoro meccanico compiuto o subito dal sistema. Endoergonica o
esoergonica si riferisce alla somma di tutti i contributi energetici, entalpici ed entropici, della
reazione (il delta G).
Buonasera Professore non ho capito l'uso delle entalpie molari standard.
Nell'esempio il deltaH della reazione intermedia è 301 kcal/mole.
Il valore di -301 kcal/mole per l'H0 molare standard del glucosio è preso dalle tavole.
E' stato misurato, ovviamente, ma l'esempio presentato a lezione non indicava come viene
misurato l'H0, ma come lo si può usare. La domanda che l'esempio si poneva
era: noti i valori di l'H0 del glucosio, dell'acqua e della CO2, come è possibile
usarli per determinare il delta H della reazione di combustione del glucosio?
Se il butano ha 2 isomeri e il pentano ha 3 isomeri. Cioè il esano (?) avra 4 isomeri etc.
Quindi c'e' una regolarita' ?
Gli isomeri aumentano molto rapidamente con il numero di atomi di carbonio e la
sequenza dell'aumento non è semplice.
Qual e' la differenza tra composti polieni e composti aromatici?
Gli aromatici sono dei tipi molto particolari di polieni ciclici e devono avere anelli a 6
atomi e una alternanza di legami doppi e semplici. Queste caratteristiche consentono la delocalizzazione
degli orbitali pi greco. Il ciclobutadiene ad esempio non e' un aromatico perche' l'anello ha solo 4 atomi.
Buongiorno professore avrei una domanda: qual è la differenza tra reazione di alogenazione e
di sostituzione nucleofila?
Sta mescolando tra loro concetti diversi. L'alogenazione e' un tipo di
modificazione chimica dell'idrocarburo, nella cui molecola viene introdotto un atomo di un
alogeno (ad es. cloro o bromo). Un esempio di idrocarburo alogenato e' il cloroetano.
Sostituzione e addizione sono meccanismi di reazione (l'addizione e' nucleofila, la
sostituzione e' invece avviene con formazione di radicali), L'alogenazione puo' essere
ottenuta per sostituzione (negli alcani) o per addizione (negli alcheni).
Salve professore Nella forma 2D3D e 2L3L D e L indicano la configurazione della molecola o il potere rotatorio?
L e D indicano la configurazione stereochimica secondo la convenzione di
Fisher. Invece l e d (o - e +) indicano il potere rotatorio, rispettivamente levogiro o
destrogiro.
Perché possiamo calcolare solamente la variazione di energia interna e mai l'energia interna assoluta di un sistema?
L'energia interna di un sistema termodinamico nel quale non avvengono trasformazioni chimiche potrebbe essere misurata su una scala assoluta.
In un sistema nel quale avvengono trasformazioni chimiche viene incluso un contributo all'energia totale dovuto all'energia dei legami chimici. Questa deve es
sere misurata rispetto ad un livello di riferimento: potrebbero essere gli atomi isolati, oppure come si fa convenzionalmente gli elementi nel loro stato eleme
ntare. In ogni caso l'energia interna totale del sistema non sarebbe assoluta ma relativa al livello di riferimento, rispetto al quale costituisce una variazio
ne.
Perché il metanolo è più solubile in acqua del butanolo?
Nel metanolo la parte apolare della molecola è piccola rispetto alla parte non polare; nel butanolo avviene l'inverso.
In una reazione reversibile all'equilibrio le costanti cinetiche della reazione diretta e della reazione inversa devono essere sempre uguali?
No, le costanti essendo costanti non possono diventare uguali nella condizione di equilibrio e diverse fuori di essa. In una reazione reversi
bile ad equilibrio sono uguali le velocità delle reazioni diretta ed inversa, che sono date dal prodotto tra le costanti cinetiche e le concentrazioni dei rea
genti. Ad esempio nella reazione di isomerizzazione A<=>B con le costanti cinetiche k1 per la trasformazione A->B e k2 per B->A, la condizione di equilibrio è
raggiunta quando k1 [A] = k2 [B] ma k1 e k2 possono benissimo essere diverse (e di solito lo sono).
Professore mi scusi non ho capito perchè applicare la convenzione di Fischer agli zuccheri con più di tre atomi di carbonio non va bene
In effetti ha capito male. La convenzione di Fisher può essere applicata ai monosaccaridi
con qualunque numero di atomi di carbonio. Il problema è che negli aldosi con più di 3 atomi
di carbonio e nei chetosi con più di 4 atomi di carbonio c'è più di un solo carbonio
asimmetrico. In questi casi si scrive l'ultimo carbonio asimmetrico secondo la convenzione di
Fisher e il carbonio precedente risulta necessariamente in una configurazione che è l'inverso
della convenzione di Fisher (anti-Fisher): cioè come spiegato negli appunti sul sito, non è
possibile scrivere due centri chirali consecutivi entrambi secondo la convenzione di Fisher.
Questo perché la convenzione di Fisher dice che i C sopra e sotto quello chirale devono
essere immaginati come se si allontanassero dall'osservatore e questo è possibile per un C
asimmetrico ma non per quello immediatamente adiacente (faccia riferimento alla figura
presentata negli appunti sugli zuccheri).
Scusi professore non ho capito questa cosa: per scindere i legami richiesta energia dunque il processo puo'
essere associato ad un processo endotermico con ΔH maggiore di zero Non capisco perche' la scissione dei legami del solvente
allora debba essere considerata con un valore entalpicamente negativo
La scissione dei legami delle molecole del solvente tra loro ha un Δ H positivo, cioe' richiede energia.
Il testo della dispensa era scritto in un modo non chiaro, ora l'ho migliorato.
Salve Professore non capisco come la minore energia dell'orbitale sigma sia
correlata all'alta intensità del campo nelle aree di sovrapposizione degli orbitali atomici
L'energia con la quale il nucleo attrae l'elettrone e' misurata prendendo
come riferimento la coppia a distanza infinita (vettore campo uguale a zero). Pertanto piu'
l'elettrone si avvicina al nucleo, piu' forte l'attrazione, minore (cioe' negativa) l'energia.
Energie negative non esistono: l'energia del campo e' negativa non in assoluto ma rispetto al
valore zero di riferimento, a distanza infinita. Nel caso degli orbitali di legame, il discorso e' lo
stesso: quanto piu' gli orbitali atomici usati per formare l'orbitale di legame sono interni e vicini
al nucleo, tanto maggiore il valore del vettore campo e tanto piu' negativa l'energia l'energia di
legame: ovvero tanto maggiore la quantità di energia che deve essere fornita dall'esterno per
rompere il legame.
Buonasera. Potrebbe illustrare come procedere per risolvere il quarto quesito? La ringrazio
No, non posso rispondere a questa domanda, per due ragioni. In primo
luogo perche' lo scopo dei quesiti e' testare la comprensione del testo che li precede;
quindi se non ha la risposta ad un quesito deve trovarla nel testo; se io la dessi in questa
sede lo scopo stesso di mettere i quesiti sarebbe vanificato; basterebbe leggere le mie
risposte anziche' il testo fornito. In secondo luogo le domande che voi mettete sul sito finiscono
tutte insieme, quindi non e' possibile sapere di quale lezione e argomento lei sta parlando.
Buonasera professore non ho capito bene la buca di potenziale
Abbiamo chiamato "buca di potenziale" il minimo locale dell'energia di
legame che si realizza quando due nuclei si trovano a distanza di legame. In questa condizione
si forma un orbitale di legame la cui energia potenziale e' inferiore (piu' stabile) rispetto a
quella degli orbitali atomici di partenza. Per una rappresentazione grafica puo' fare riferimento
alla figura 3 della lezione sul legame chimico.
Buonasera Professore riguardo la dissociazione di un acido debole mi chiedevo
da dove derivasse [OH-] quando eguagliamo le concentrazioni delle cariche. Grazie
Bellelli: come spiegato nel testo, una soluzione di qualunque soluto (quindi
anche di un acido debole) deve obbedire al requisito dell'elettroneutralità: cioè la somma delle
cariche negative deve uguagliare la somma delle cariche positive e la carica netta totale del
sistema deve essere zero. Le specie cariche negativamente sono due: A- e
OH-; la specie carica positivamente è una sola, H3O+;
pertanto: [A-] + [OH-] = [H3O+].
In questa frase presa dalla spiegazione dell'idrolisi acida intendeva dire esclude o include
Ki e come al solito include la concentrazione dell'acqua
Bellelli: La Ki include in sé la concentrazione dell'acqua, come si può facilmente vedere
se si scrive la legge di azione delle masse per la reazione di idrolisi. E' lo stesso che per la Ka o la Kb.
Buonasera prof non ho capito come si calcola in NO dei singoli atomi di carbonio in una molecola
Bellelli: devi scrivere la formula di struttura e considerare separatamente ciascun atomo
di carbonio; per ogni legame chimico devi assegnare gli elettroni di legamiall'atomo più elettronegativo e
calcolare la carica finale dell'atomo di carbonio. Ad esempio nel metano CH4, ci sono 4 legami C-H. Le
elettronegatività sono 2,5 per C e 2,1. Quindi gli elettroni di ciascun legame sono attribuiti tutti al C (più
eletronegativo). Ogni legame contiene 2 elettroni, uno del C e uno di H: quindi il C riceve i suoi 4 elettroni
(che non contano e i 4 dei 4 idrogeni: NO= -4. Ciascun idrogeno cede il suo elettrone e la sua carica risulta
NO=+1.
Prof. ma per i gruppi funzionali come calcoliamo l'elettronegatività?
Bellelli: l'elettronegatività è definita per i singoli atomi, non per i gruppi. E' possibile
misurare l'elettronegatività di un gruppo (ad es. -CCl3) ma non c'è un metodo di
"calcolo"; tut'al piu' ci sono tabelle un po' specialistiche per i gruppi piu' comuni.
Buonasera Professore avrei una domanda: esiste un metodo per capire se un acido o una base
sono forti o deboli direttamente dalla formula bruta?
Bellelli: dalla formula bruta no. Dalla formula di struttura, e conoscendo alcuni composti
simili si possono fare ragionevoli previsioni. In linea di massima un acido è tanto più forte
quanto più elettronegativo è l'atomo o il gruppo legato all'idrogeno che dissocia.
Ad esempio HCl è forte; HNO2 è debole ma se noi aggiungiamo un ossigeno
per fare HNO3 questo rende piu' elettronegativo il gruppo e HNO3
diventa forte; etc. Negli ossiacidi quanto più ossigeno è presente nel gruppo legato all'idrogeno
tanto più l'acido è forte (ad es. H2SO4 è più forte di H2SO3).
Buonasera lei dice sia in classe che sul sito che l'ossigeno non formi composti
con il fluoro. OF2 Fluoruro di ossigeno esiste solo in certo ambiente. Grazie
Bellelli: ha ragione. Sarebbe piu' corretto dire che non ci sono composti
naturali nei quali l'ossigeno e' legato col fluoro. In laboratorio noi abbiamo a disposizione
energie e condizioni sperimentali che ci consentono di sintetizzare composti non presenti in
natura, come OF2. OF2 e' un ossidante estremamente energico nel quale l'ossigeno ha numero
di ossidazione +2 e se fosse presente nell'ambiente reagirebbe immediatamente con
praticamente qualunque cosa per produrre composti nei quali l'ossigeno avrebbe n.o. -2.
Non ho capito perchè se l'elettrone genera un campo elettromagnetico per lo
spin dopo c'è scritto che il campo magnetico è nullo
Bellelli: dove ha trovato questa affermazione? Ad ogni modo presumo che
la frase dica che se in un atomo o molecola ci sono elettroni in coppie negli orbitali, essi hanno
spin opposto per il principio di Pauli e il campo magnetico risultante è nullo (+1/2 -1/2 = 0).
Se gli elettroni non sono in coppie con spin opposto il campo magnetico non e' nullo. In pratica:
bisogna sommare i numeri di spin di tutti gli elettroni dell'atomo o della molecola. Se il risultato
è zero il campo magnetico elettronico è nullo e l'atomo o la molecola è diamagnetico; se invece
il risultato è diverso da zero l'atomo o la molecola possiede suscettibilità paramagnetica.
Gentile professore non ho compreso la relazione tra l’aumentata intensità del
campo elettrostatico e la diminuita energia dell’orbitale di legame. la ringrazio.
Bellelli: l'energia in questo contesto è definita rispetto a quella di un nucleo
e un elettrone non interagenti, posti a distanza infinita. Se l'elettrone si avvicina al nucleo ed
entra in un orbitale, emette energia e scende ad un livello di energia più basso di quello di
riferimento, come una persona che scende lo scalino di una scala. L'energia dell'elettrone in un
orbitale (atommico o di legame) è quindi negativa rispetto al livello di riferimento, esattamente
come l'energia di una palla da golf caduta in una buca è negativa rispetto a quella della stessa
palla appoggiata sul suolo. E infatti per estrarre la palla dalla buca, o l'elettrone dall'orbitale
è necessario fornire energia.
Buongiorno professore volevo chiederle se poteva chiarirmi la differenza tra
carica e polarità… grazie mille
Bellelli: la carica elettrica è una grandezza fisica fondamentale come la
massa o l'energia. la polarità è una proprietà delle molecole che dipende da come sono
distribuite le cariche al loro interno. Se il centro delle cariche positive coincide col centro delle
cariche negative la molecola è non polare; se invece i due centri non coincidono la molecola è
polare e presenta una maggiore localizzazione di carica positiva ad una estremità ed una di
carica negativa all'estremità opposta.
Buongiorno professore. Come mai nell acido fosforico il fosforo riceve degli
elettroni dal quarto atomo di ossigeno nell'orbitale 3d e non 4s?
Bellelli: l'orbitale 4s ha una forma che non gli consente di formare un
orbitale di legame pi greco.
Salve professore, perché la risposta all’esercizio 1 è 24,4 e non 22,4?
Bellelli: controllerò l'esercizio. Il volume molare del gas perfetto si calcola
con la formula V = RT / P (e n=1 per definizione di volume molare). Alla pressione di 1 atm il
volume molare del gas perfetto (calcolato con la formula data prima, provare per credere)
risulta 22,4 L se T=273 K (0 C), e 24,4 L se T=298 K (25 C).
Buonasera professore parlando del composto B(OH)3 che significa che il legame O-H è
più polarizzato del legame B-O e in che modo questo influenza la dissociazione del composto?
Bellelli: i valori di elettronegatività dalla tavola periodica sono: H=2,1; B=2,04; O=3,5.
Nel tri-idrossido di boro, comunemente chiamato acido borico, il legame B-O e il legame O-H hanno
praticamente la stessa polarizzazione; però il boro è legato a tre ossigeni, ogni idrogeno ad un solo
ossigeno. Questo rende il boro più elettronegativo. Il risultato è che il composto in acqua dissocia uno ione
idrogeno anziché tre ioni idrossido.
Salve professore perché la risposta all’esercizio 1 è 24,4 e non 22,4?
Bellelli: ho già risposto sopra a questa domanda. Ma lei ha provato a fare il
calcolo? La formula è V = nRT / P. Prenda n=1, R=0,0821, T=273+25=298 K e P=1 atm e veda
quanto viene.
Buonasera professore Non ho ben capito come si calcola in maniera indiretta la volemia del sangue.
A cosa serve iniettare l'albumina?
Bellelli: per misurare la volemia si applica la formula V= n/C. Serve n, il
numero di molti di un tracciante, la sostanza iniettata dal medico che si distribuisca nel volume
del liquido da misurare. Può usare albumina marcato col cromo radioattivo (che nel nostro
sangue non c'è: c'è l'albumina non marcata) o un altro tracciante, ma qualcosa deve iniettare
nel sangue, che sia estranea ad esso e facilmente misurabile, in modo che n e C siano determinabili.
Buonasera professore non ho molto chiare le applicazioni della legge di Henry quando il gas reagisce con il liquido
Bellelli: se un gas reagisce col solvente si trova in soluzione in varie forme
e tra queste soltanto quella che ha la stessa formula della fase gassosa segue la legge di Henry.
Ad esempio la CO2 si scioglie in acqua e reagisce con l'acqua per formare acido carbonico e
bicarbonato; soltanto la CO2 disciolta è in equilibrio col gas secondo la legge di Henry, acido
carbonico e bicarbonato non seguono la legge di Henry.
Buonasera professore Non ho capito come mai se H reagenti < H prodotti i
legami presenti nelle molecole dei reagenti siano meno stabili (forti)
Bellelli: questa è una difficoltà comune quando si inizia lo studio della
termodinamica chimica. Lo stato più stabile di un sistema è quello che ha convertito la sua
energia potenziale in energia di legame. Ad esempio un sasso sospeso in aria ha energia
potenziale di tipo gravitazionale ed è in una condizione instabile. Quando cade converte la sua
energia potenziale prima in energia cinetica e poi al momento dell'urto con il suolo in calore,
e acquista una condizione stabile. Due atomi isolati e inizialmente tanto distanti che le forze
attrattive tra loro siano nulle possono avvicinarsi e formare un legame liberando energia sotto
forma di calore (cioè entalpia): questo significa che hanno raggiunto una condizione più
stabile (quella di molecola anziché di atomi isolati), perdendo una energia potenziale. Quindi
lo stato di molecola è più stabile di quello di atomi isolati perché la reazione di formazione del
legame è: 2 atomi --> molecola + calore (H). Per la legge di conservazione dell'energia
abbiamo: H molecola + calore di reazione = H atomi e la molecola è stabile perché
H molecola < H atomi. Generalizzando, se H prodotti < H reagenti la reazione sarà esotermica
e i prodotti saranno più stabili dei reagenti (a meno dei contributi entropici dei quali avremmo
dovuto tenere conto fin dall'inizio, utilizzando la funzione G anziché la H, con
Δ G = Δ H - T Δ S)
Mi scusi professore ma perché nel calcolo dell'entalpia nella reazione di formazione di H2O l'entalpia
è espressa su moli di O2?
Bellelli: l'entalpia deve sempre essere espressa in kcal/mole ed è quindi riferita alla
quantità di sostanza considerata; nella reazione di formazione dell'acqua la abbiamo espressa in
due modi: per mole di O2 consumato oppure per mole di acqua formata, e naturalmente il
primo valore è pari al doppio del secondo, perché il consumo di una mole di O2 porta alla
formazione di due moli di H2O
Buonasera professore vorrei chiedere perchè in riferimento alla costante di
equilibrio nel calcolo delle grammomoli non consideriamo i coefficienti stechiometrici?
Bellelli: non capisco questa domanda. Negli esercizi sul calcolo della
costante di equilibrio noi consideriamo i coefficienti stechiometrici quando calcoliamo le moli
di reagente consumate e le moli di prodotto formate. Provi a rifare questa domanda a lezione in
occasione di una delle nostre esercitazioni di stechiometria, così lo vediamo direttamente nel
calcolo.
Buonasera professore. Come si fanno a vedere le correzioni delle domande
alla fine di ogni "capitolo"? Riesco a vedere solo il punteggio. Grazie mille.
Bellelli: il programma non prevede di mostrare le risposte esatte alle 4
domande alla fine di ogni capitolo, perche' altrimenti lo scopo della verifica sarebbe vanificato:
anziché studiare il materiale fornito basterebbe premere invio, prendere nota delle risposte
esatte e ripetere la procedura, sempre senza leggere il materiale fornito.
A scopo di esercizi, vengono forniti per ogni capitolo degli "esercizi e quesiti" per i quali il
programma fornisce le risposte esatte e anche alcune spiegazioni.
Buonasera professore in merito all'equilibrio chimico in sistemi biologici il
termine costante di dissociazione è usato come sinonimo di costante di equilibrio?
Bellelli: si, l'esempio fornito è l'equilibrio della mioglobina con l'ossigeno e
la reazione, essendo reversibile, può essere scritta in entrambe le direzioni:
Mb + O2 <==> MbO2
oppure
MbO2 <==> Mb + O2
Le rispettive costanti di equilibrio sono l'una il reciproco dell'altra e vengono indicate
rispettivamente come costante di associazione (o di combinazione) e costante di dissociazione.
Nel trattamento algebrico del sistema viene usata la costante di dissociazione, per ragioni
spiegate nel testo.
Salve. Non ho ben compreso perché la sovrapposizione dei campi elettrostatici
comporta la minor energia dell'orbitale di legame rispetto a quelli atomici
Bellelli: Gli elettroni, che hanno carica negativa sono attratti dal nucleo, che
ha carica positiva. Il livello zero di attrazione si ha quando la distanza tra elettrone e nucleo è
infinita. Quando l'elettrone di trova a breve distanza dal nucleo (in un orbitale atomico) si trova
in una regione di minore energia rispetto al livello zero. Quando due nuclei si avvicinano e
sovrappongono e fondono i loro orbitali, il livello energetico dell'orbitale di legame e' ancora
minore (cioe' l'intensita' del campo elettrostatico positivo, che attira gli elettroni, è maggiore).
Prenda come esempio un sasso attratto dal campo gravitazionale della terra. A distanza infinita
l'attrazione è nulla; quello è il livello zero. Se il sasso cade sulla terra raggiunge una regione di
maggiore fora attrattiva e di minore energia potenziale (condizione dell'elettrone nell'orbitale
atomico). Se lei scava una buca e ci fa cadere dentro il sasso l'energia potenziale è ancora
minore (condizione dell'elettrone nell'orbitale di legame).
Buonasera professore. Il radicale libero Cl° con un elettrone spaiato nella
reazione CH4 + Cl2 si comporta da elettrofilo anche se ha sette elettroni sul livello elettronico
esterno?
Bellelli: non posso rispondere a questa domanda cosi' come e' posta
perché contiene vari errori, o forse sono io che capisco male.
Un composto o ione o atomo nucleofilo possiede almeno una coppia di elettroni non impegnata
in legami nello strato di valenza; tipicamente corrisponde ad una base di Lewis; un elettrofilo
ha uno strato elettronico esterno incompleto e può accettare legami dativi; tipicamente è un
acido di Lewis. Un radicale è caratterizzato da almeno un elettrone spaiato nello strato di
valenza (non una coppia in un orbitale!), quindi ad un radicale la definizione di nucleofilo o
elettrofilo si adatta malamente.
La reazione CH4 + Cl2 non è descritta tra gli esempi proposti; il suo prodotto è CH2Cl-CH2Cl
e non avviene con meccanismo radicalico; il Cl2 attacca l'orbitale pi greco del doppio legame.
La reazione descritta tra gli esempi è la molto piu' classica C2H4 + HCl --> C2H5Cl. Questa
avviene con meccanismo di addizione elettrofila perché l'H+ è un elettrofilo e attacca il doppio
legame.
Il meccanismo radicalico, più difficile da innescare, è quello della reazione
C2H6 + Cl2 -> C2H5Cl + HCl
Per ottenere questa reazione bisogna prima produrre in qualche modo il radicale che può essere
C2H5° oppure Cl°. Il radicale sposta su di se uno degli elettroni di un orbitale sigma e genera
il prodotto e un nuovo radicale che va a fare una nuova reazione (meccanismo a catena).
Salve professore. Non ho ben compreso il concetto di fase termodinamica
Bellelli: la fase è una porzione del sistema termodinamico considerato nella
quale tutte le molecole appartengono ad un unico corpo; dal punto di vista chimico le molecole
possono essere uguali o diverse tra loro. Ad esempio un gas puro costituisce un'unica fase e
anche una miscela gassosa costituisce un'unica fase (ogni molecola è libera di incontrare tutte
le altre). Due liquidi immiscibili o due solidi costituiscono fasi distinte, perché le molecole del
primo corpo non possono incontrare quelle del secondo corpo.
Salve professore. Non ho ben compreso la differenza tra n diss = n e nparticelle diss = n = n ν α
Bellelli: Non sono sicuro di aver capito la domanda. Supponga di avere due
mandarini in un piatto e di chiedersi quanti corpi sono presenti nel piatto. Evidentemente fin qui
la risposta e' n_totale=2 e n_corpi=2.
Ora prenda un mandarino e lo dissoci nei suoi spicchi; supponiamo che gli spicchi siano 8. Alla
domanda su quanti corpi sono presenti nel piatto risponderemo: n_totale=2 (i mandarini sono
sempre 2); n_corpi=9 (somma di 1 mandarino indissociato e uno dissociato in v = 8 spicchi.
La formula generale per rispondere risulta quindi:
n_corpi=n_indissociati + (n_dissociati x v)
n_indissociati = n_totale x a (nel nostro esempio: n_totali=2 a=0,5)
n_dissociati x v = n_totale x a x v (nel nostro esempio: 2 x 0,5 x 8)
Perché la N-acetil glucosammina viene considerata un'ammina e non
un'ammide secondaria anche se deriva da un'ammina primaria e un acido carbossilico?
Bellelli: formalmente il gruppo funzionale è dato dal legame amidico; però
dal punto di vista della biochimica prima viene formata la glucosamina e successivamente
questa viene acetilata. Quindi il nome del composto descrive una glucosamina modificata.
Buonasera Professore. Perché avviene l'effetto induttivo del sostituente
sull'aromaticità dell'anello benzenico? Mi riferisco ai gruppi attivanti e disattivanti.
Bellelli: questa domanda riguarda i meccanismi di reazione e più
precisamente la facilitazione indotta dai sostituenti dell'anello aromatico nei confronti delle
reazioni di sostituzione. Riguarda quindi un argomento che noi non trattiamo in modo
approfondito nel nostro programma. In sostanza se un sostituente è capace di "donare"
elettroni all'anello pi greco delocalizzato (ad es. un gruppo OH come nel fenolo o addirittura O-
nello ione fenato) questo si comporta come un attivante e facilita le reazioni di sostituzione, a
discapito di quelle di addizione; per contro un gruppo che attrae elettroni tende a favorire ibridi
di risonanza parzialmente non aromatici e facilita le reazioni di addizione. Però io le consiglio
fortemente, se questo è il suo interesse, di fare riferimento a un testo di Chimica Organica più
approfondito di quelli da noi adottati in questo corso, magari ricorrendo ad una biblioteca
specializzata.
Salve professore non ho capito da quali calcoli deriva il valore di ΔH=300 Kcal
mole nella reazione di combustione del glucosio.
Bellelli: premesso che il ΔH di combustione del glucosio è -670 kcal/mole,
il ragionamento è spiegato dettagliatamente nella lezione sulle reazioni chimiche, che le
consiglio di rileggere. In sostanza se il calore molare di formazione del glucosio a partire da C,
H2 e O2 (dalle tabelle) è di -300 kcal/mole, mentre quelli di
H2O e CO2 sono rispettivamente -58 e -94 kcal/mole la reazione
di combustione del glucosio presenterà un ΔH pari alla somma algebrica dei valori di
H0 del glucosio (cambiato di segno perché è il reagente) più quelli dei prodotti,
ciascuno moltiplicato per il suo coefficiente stechiometrico: -(-300) + 6x(-58) + 6x(-94) = -670 kcal/mole.
Buonasera Professore. è possibile che la formula di struttura del fruttosio
secondo Haworth sul sito sia errata? Cercando su internet sembra differente. Grazie
Bellelli: tutti possiamo sbagliare, ma quella formula mi sembra corretta.
Tenga presente che la rappresentazione data sul sito pone il C2 a sinistra, invece che a destra
come viene piu' comunemente fatto. Se una formula di Haworth viene girata, le posizioni di
tutti i sostituenti chirali vanno invertite (gli OH che stavano sopra vanno sotto e viceversa). La
ragione per invertire l'orientamento di una formula e' quella di semplificare la rappresentazione
di alcuni possibili composti; ad esempio in genere si rappresenta in questo modo il fruttosio del
saccarosio. Provi a confrontare la formula data sul sito con quella del fruttosio nel saccarosio.
Buonasera professore, la formazione del solido cristallino è un processo
endoergonico. può esserlo in casi particolari
Bellelli: la sua domanda è incompleta, pertanto non è possibile dare una
risposta univoca. Qual è il processo che lei immagina? Cioè le parla di formazione del solido
cristallino a partire da cosa? Il solido cristallino è uno stato, non un processo. Ad esempio un
processo potrebbe essere la formazione del solido cristallino a partire dalla soluzione
sovrasatura di un sale. A seconda del sale che lei considera il processo può essere sia
endoergonico che esoergonico e lei se ne accorge dalla variazione della solubilità del sale in
funzione della temperatura. Nella maggioranza dei casi la solubilità dei sali aumenta
all'aumentare della temperatura, e questo rivela che la dissoluzione del solido è endoergonica
(quindi la formazione del solido è esoergonica). In alcuni casi però la solubilità del sale
diminuisce all'aumentare della temperatura, ad esempio per il solfato di calcio; questo ci rivela
che la dissoluzione del solido è esoergonica (quindi la formazione del solido è esoergonica).
Salve professore mi può spiegare il ruolo della tensione di vapore a livello
alveolare? può anche mettere un link se preferisce.
Bellelli: a 37°C la tensione di vapore saturo dell'acqua e' 44 mmHg. L'aria
che noi respiriamo ha un contenuto di vapore d'acqua molto inferiore: perché non è satura e
perché in genere si trova ad una temperatura inferiore (a 25°C la tensione di vapore saturo
dell'acqua è 18 mmHg). Le vie respiratorie devono fornire acqua e che evapora e satura di
vapore acqueo l'aria inspirata. Questo comporta che con l'espirazione noi perdiamo acqua (circa
300 mL/die; cosiddetta perspiratio insensibilis). Poiché l'alveolo polmonare è rivestito da un
sottilissimo film di liquido, si comporta come una bollicina e risente della tensione superficiale
dell'aqua che tenderebbe a farlo restringere. Questo effetto è minimizzato dalla presenza di
secreti tensioattivi (surfactanti).
Come faccio a sapere qual è la possibile ibridazione per l’atomo di carbonio?
Bellelli: il carbonio tende allo stato di massima ibridizzazione possibile, però
mentre l'orbitale di legame sigma può essere formato da qualsiasi orbitale atomico, l'orbitale pi
greco puo' essere formato soltanto da orbitali atomici p non ibridizzati. Quindi lei deve guardare
il suo atomo di carbonio e contare quanti orbitali pi greco forma. Se possiede soltanto legami
semplici (ad es. il metano) forma soltanto orbitali di legame di tipo sigma e la sua ibridazione è
la più alta possibile, cioè sp3. Se forma un solo legame doppio (ad es. la
formaldeide) ha tre orbitali sigma e un orbitale pi greco, derivante da un orbitale atomico p non
ibridizzato; quindi la sua ibridazione è sp2. Se forma due legami doppi (ad es.
l'anidride carbonica) o un legame triplo (ad es. l'etino) ha due orbitali sigma e due orbitali pi
greco, derivanti da due orbitali atomici p non ibridizzati; quindi la sua ibridazione è sp.
Salve professore mi può spiegare cosa avviene dopo il punto di equivalenza durante le titolazioni?
Bellelli: quando viene superato il punto di equivalenza in una titolazione
il segnale osservato è dato dall'eccesso di titolante libero. Ad esempio in una titolazione di
acido acetico con NaOH, al punto di equivalente è presente soltanto CH3COONa
e il pH (che in questa titolazione è il segnale) è dato dall'idrolisi del sale. Se viene aggiunta
ulteriore NaOH ci sarà in soluzione un eccesso di base forte non tamponata che determinerà
il pH (secondo la regola [OH-] = Cb); il contributo del CH3COONa
al pH sarà trascurabile.
Mi scusi professore la frazione molare della soluzione glucosata al 5 p/v non
riesco a capire cosa sono gli altri 95 siccome non scritto nella domanda.
Bellelli: la glucosata è una soluzione acquosa contenente il 5% di glucosio
espresso come rapporto peso/volume (p/v). Quindi questa soluzione contiene 5 g di glucosio
in 100 mL di volume totale. Il rimanente "95" è acqua però non è corretto in un rapporto peso
volume utilizzare la sottrazione. Conoscendo la densità lei potrebbe convertire la percentuale
peso/volume in una percentuale peso/peso, per la quale la sottrazione sarebbe applicabile.
Ad esempio se la densità fosse esattamente 1 g/mL, 100 mL peserebbero 100 g e la soluzione
sarebbe composta da 5 g di glucosio e 95 g di acqua. Questi concetti sono spiegati nella lezione
sulle soluzioni.
Buonasera prof. ha un consiglio sul modo migliore per studiare le formule per l'esame?
Sto avendo difficoltà a memorizzarle.
Bellelli: ovviamente ci vuole molto esercizio. Provi a scrivere le formule di
struttura nel modo più esplicito possibile indicando ogni atomo e ogni legame; eviti, almeno
inizialmente, quelle rappresentazioni nelle quali gli atomi sono sottintesi (linee spezzate, etc.).
Controlli che i legami che attribuisce agli atomi siano consistenti con la loro capacità di formare
legami: il C deve sempre fare 4 legami, O 2 legami, etc. In caso di dubbio provi a scrivere la
rappresentazione di Lewis, nella quale ogni elettrone dello strato esterno è rappresentato con
un puntino; ogni legame deve avere due elettroni.
Come faccio a sapere qual è la possibile ibridazione per l’atomo di carbonio?
Bellelli: la risposta a questa domanda sta nella
lezione sulla Chimica Organica
dove lei trova un paragrafo intitolato: "RICONOSCERE L'IBRIDAZIONE DEL CARBONIO (E DI
QUALUNQUE ALTRO ATOMO)." Sarebbe un errore didattico da parte mia ripetere in questa sede
le spiegazioni gia' date, meglio, sul materiale didattico fornito. Se quella parte non le risulta
chiara mi formuli una nuova domanda, più precisa.
Buonasera professore e' corretto dire che un ambiente acido e' tendenzialmente un ambiente ossidante?
Bellelli: lei fa una strana domanda, che richiede una risposta complicata.
Diciamo che, in prima approssimazione, che non c'è ovvia relazione tra un ambiente acido e un
ambiente ossidante: acido vuol dire ad elevata concentrazione di ione idrogeno, ossidante vuol
dire che ha una elevata concentrazione di un agente ossidante.
Saliamo ora un gradino nel dettaglio della nostra analisi: lo ione idrogeno è la specie ossidata
della coppia H2/H+; quindi un ambiente acido risulta ossidante nei
confronti di qualunque specie chimica che abbia un potenziale standard negativo. Ad esempio
se noi aggiungiamo zinco metallico ad una soluzione di un acido forte osserviamo la reazione:
In questa reazione lo ione idrogeno è l'ossidante e si riduce a idrogeno gassoso, mentre lo zinco
metallico è il riducente (E0 = -0,76 V) e si ossida a ione zinco. Dunque, in
presenza di un riducente sufficientemente energico una soluzione acida risulta ossidante, e
quanto più è acida (cioè quanto più basso è il suo pH) tanto più è ossidante.
Saliamo ora un altro gradino nel dettaglio della nostra analisi: l'atmosfera contiene ossigeno che
è un ossidante molto energico, e l'ossigeno si discioglie in acqua seguendo la legge di Henry;
quindi, a meno di non preparare le nostre soluzioni in una atmosfera di un gas inerte (ad es.
azoto o argon), tutte le nostre soluzioni e anche l'acqua pura si comporteranno come ossidanti,
a causa dell'ossigeno in esse contenuto.
In una soluzione acida, lo ione idrogeno (o anche il suo controione; ad esempio Cl-) può
avere un effetto catalitico sulle reazioni di ossidazione dovute all'ossigeno disciolto, oppure può
partecipare in altro modo alla reazione stessa; ad esempio la semireazione di riduzione dello
ione cromato:
richiede ione idrogeno come reagente; in questa reazione lo ione idrogeno non si comporta
né da ossidante né da riducente (il suo numero di ossidazione rimane invariato), ma è richiesto
dalla stechiometria di reazione e appare nell'equazione di Nernst. Chiaramente la semireazione
è favorita (qualunque sia la specie riducente utilizzata come donatore di elettroni) in ambiente
acido, per il principio di Le Chatelier, però è una semireazione di riduzione: questo
vuol dire che in questo caso l'ambiente acido favorisce una riduzione, anziché una ossidazione!
Non ho capito la frase: il prodotto tra le incertezze delle misure di posizione
e velocità non può essere inferiore ad una funzione della costante di Plank
Bellelli: le grandezze velocità e posizione sono tra loro complementari;
ovvero devono essere determinate insieme: non possiamo conoscere la velocità di una
particella se non sappiamo dove si trova. Quando due grandezze sono complementari, anche
l'incertezza della loro misura risulta correlata: cioè l'inevitabile errore di misura non è su
ciascuna ma sulla coppia (principio della complementarità di Bohr). Questo implica che se una
delle due in un esperimento è misurata con grande precisione, l'altra sarà imprecisa. Non si può
risolvere questo problema con strumenti più precisi perché al livello degli oggetti quantistici
tutte le grandezze sono anche quantistiche e l'incertezza sul prodotto quantità di moto x posizione
non può essere inferiore alla metà della costante di Plank ridotta che è appunto una misura
della discontinuità degli oggetti quantistici.
Buonasera Professore non ho ben capito la diapositiva sulla spettroscopia di
assorbimento come funziona il come leggere il grafico sotto
Bellelli: una domanda di questo tipo, che richiede la discussione di un
grafico va fatta in classe; me la proponga alla prossima lezione.
Buonasera professore, potrebbe spiegarmi brevemente la sovrapposizione
degli orbitali ibridi S e P? Grazie.
Bellelli: questa domanda è già stata posta su questo sito; se scorre lo
storico verso l'alto trova domanda e risposta.
Buonasera professore. Qual è la differenza tra forze di London e forze di Van der Waals?
Bellelli: di solito si intende per forse di Van der Waals l'insieme di tutti i tipi di interazioni deboli e per forze di London le interazio
ni deboli non elettrostatiche (quindi con l'esclusione delle interazioni dipolo-dipolo, ione-dipolo e legame idrogeno.
buonasera professore volevo chiederle se per caso fosse possibile spiegare il
procedimento della prima domanda del capitolo sulle soluzioni, quella della frazione molare.
Bellelli: la domanda chiede di convertire una molarita' in una frazione molare.
Prendendo 1 L di soluzione, il numero di moli del soluto è uguale alla sua molarità. Il numero di
moli del solvente è dato dal peso del solvente diviso per il suo peso molecolare. Il peso del
solvente è dato da: [volume (1 L) x densità - peso del soluto].
La frazione molare del soluto è X = moli soluto / (moli soluto + moli solvente).
Buongiorno prof. come mai composti come il pirano o il tetraidrofurano sono
considerati alifatici pur avendo una catena chiusa?
Bellelli: perche' un composto sia aromatico non basta che sia ciclico: deve
avere doppi legami e orbitali pi greco delocalizzati; inoltre la regola di Huckel richiede che gli
elettroni negli orbitali pi greco siano 4n+2 dove n e' il numero degli anelli presenti nel
composto. Ad esempio non sono aromatici ne' il cicloesano (che e' ciclico ma non ha doppi
legami), ne' il cicloesene (ciclico con un solo doppio legame), ne' il cicloesadiene (ciclico con
due doppi legami), mentre e' aromatico il benzene (=cicloesatriene, con un solo anello a sei
atomi, tre doppi legami e 6 elettroni negli orbitali pi greco)
Buonasera prof. Perche' nel calcolo dell'entalpia rusulta H = Q = 116
kcal/moleO2 e non 16 kcal/moleH2O
Bellelli: perche' in quell'esempio sono state calcolate le energie di legame
per la reazione di una molecola di ossigeno (116 kcal/moleO2), che forma due molecole di
acqua; quindi abbiamo ottenuto kcal per mole di ossigeno o kcal per due moli di H2O.
Buongiorno prof mi può spiegare per quale motivo si ha Ca = [HA]?
Bellelli: non viene indicato il tipo di soluzione alla quale lei si riferisce. In
una soluzione di acido debole si ha Ca = [HA] + [A-] (questa è la legge di conservazione delle
masse). Se l'acido è debole e Ca è grande rispetto alla Ka (ad es. Ca = 0,1 M; Ka = 10-5 M)
allora avremo che [HA] >> [A-], e nella somma [HA]+[A-] è lecito trascurare il contributo di
[A-]; pertanto [HA] = Ca. In un tampone il ragionamento è lo stesso ma in questo caso
abbiamo il componente [A-] derivante dalla dissociazione del sale; pertanto dobbiamo
approssimare [HA]=Ca e [A-]=Cs.
Buongiorno prof perché la reazione A+B -> AB -> C è bimolecolare anche da AB a C?
Bellelli: la reazione indicata nello schema è composta da due processi
successivi: A+B -> AB bimolecolare e (presumibilmente) di secondo ordine; e AB -> C
monomolecolare e (presumibilmente) di primo ordine. Dove ha trovato che AB -> C è
bimolecolare?
Buonasera professore. Per quali valori di Ka posso considerare un acido forte
o debole? Esiste un valore che funge da spartiacque tra le due categorie?
Bellelli: non esiste un vero valore di soglia. In termini approssimativi l'acido
forte non ha una Ka perché dissocia interamente e ad equilibrio la forma indissociata non è più
presente. Se lei vuole un discorso più preciso, nessuna reazione è veramente irreversibile e
anche un acido forte ha una Ka che però è maggiore delle concentrazioni di acido praticamente
utilizzabili. Deve considerare che per la legge di Ostwald, se lei discioglie in acqua un acido ad
una concentrazione pari al doppio della sua Ka, ottiene un grado di dissociazione pari a 0,5; per
ottenere un grado di dissociazione del 90% deve usare una concentrazione pari a 1/8 della Ka.
Se noi accettiamo l'approssimazione che un acido è interamente dissociato, quindi forte, se il
suo grado di dissociazione alfa uguaglia o supera il 90%, allora un acido forte ha una Ka che è
pari o superiore a 8 volte la concentrazione massima che lei intende utilizzare. Ad esempio se la
concentrazione massima che lei può disciogliere è 1 M un acido forte deve avere Ka = 8 M.
Buonasera professore, mi può rispiegare come faccio ad approssimare
[HCOOH] = Ca e [HCOO-] = Cs nella soluzione tampone?
Bellelli: prendiamo il tampone costituito da HCOOH e HCOONa. Per la legge
di conservazione della carica abbiamo: [H3O+] + [Na+] = [OH-] + [HCOO-] (la somma delle
cariche negative uguaglia la somma delle cariche positive). Siccome [H3O+] e [OH-] sono
entrambi piccoli rispetto a [Na+] e [HCOO-] possiamo approssimare [Na+] = [HCOO-]; ma noi
sappiamo che [Na+]=Cs per cui [HCOO-]=Cs. Per la legge di conservazione della massa noi
sappiamo che Ca+Cs=[HCOOH]+[HCOO-]; ma noi abbiamo già approssimato [HCOO-]=Cs,
quindi l'equazione precedente si risolve in Ca=[HCOOH].
buonasera professore; perché qualunque tipo di misurazione di un elettrone è
sufficiente affinché questo ci appaia come particella?
Bellelli: non sono sicuro di aver capito bene la domanda. L'elettrone ci può
apparire come particella o come onda a seconda del tipo di misurazione che noi facciamo;
quindi non è vero che qualunque tipo di misurazione ci farà apparire l'elettrone come particella.
L'elettrone gode della proprietà della molteplicità di stato, cioè è sia onda che particella; oppure
forse dovremmo dire che alle dimensioni dell'elettrone onda e particella non sono due cose
così distinte come ci appaiono nel mondo macroscopico. A seconda dell'esperimento che
facciamo riveliamo proprietà caratteristiche dell'onda o della particella.
Salve professore, non ho ben capito la differenza tra potenziale elettrostatico e potenziale elettrochimico.
Bellelli: il potenziale elettrochimico e' dato dalle tendenza di un atomo, ione
o composto a cedere o acquistare elettroni e corrisponde al potenziale redox standard della
semireazione considerata (per intenderci quello che trova nella tabella dei potenziali redox). Il
potenziale elettrostatico e' invece dato dall'accumulo di carica: il fusso di elettroni in una pila
rende una semicella positiva e una negativa, generando nell'una un eccesso di ioni positivi,
nell'altra un eccesso di ioni negativi.
In che modo la seconda dissociazione del fosfato avendo pKa = 7,2 svolge il ruolo di tampone nel sangue?
Bellelli: La seconda dissociazione del fosfato e':
H2PO4- + H2O <=> HPO4-2 + H3O+.
In questa reazione il composto H2PO4- si comporta come un acido mentre il composto HPO4-2
e' la sua base coniugata; i due costituiscono quindi un tampone.
Salve Non mi e' ben chiaro questo passaggio: quando il gas e' presente in
soluzione in varie forme, la legge di Henry applica soltanto alla forma che
e' uguale negli stati si soluto e gassoso.
Bellelli: se lei considera un gas come l'ossigeno, questo ha la formula
O2 sia in fase gassosa che in soluzione e rispetta sempre la legge di Henry.
Se lei invece considera un gas come la CO2, questa ha la formula
CO2 nella fase gassosa, mentre in soluzione acquosa reagisce con l'acqua
secondo le reazioni:
CO2 + H2O <=> H2CO3 <=> HCO3- + H3O+
l'equilibrio tra la fase gassosa e quella di soluzione e' possibile soltanto per la specie
CO2, mentre le specie H2CO3 e HCO3- non possono passare nella fase gassosa.
Buonasera professore non ho ben chiaro cosa rappresenta il termine Eo nell'equazione di Nernst
Bellelli: il termine Eo nell'equazione di Nernst per il potenziale di semicella
rappresenta il potenziale redox standard della coppia redox presente nella semicella, e si trova
sulla tabella dei potenziali redox.
Buonasera, perchè il secondo S nello ione iposolfito ha n.o. -2 e non -1 che è l'elettrone che prende dallo S centrale ossia come fa a compor
tarsi come un ?
Bellelli: l'iposolfito, il cui nome e' stato cambiato in tiosolfato, ha la stessa
struttura elettronica del solfato, e i due atomi di zolfo hanno numeri di ossidazione diversi;
quello al centro ha no=+6, come nel solfato; quello esterno occupa una posizione e un ruolo
analogo a quello di uno degli ossigeni del solfato ed ha lo stesso numero di ossidazione di quelli,
cioe' -2.
Salve professore, visto che nello spazio la pressione e uguale a zero, la
temperatura allora non dovrebbe essere uguale a 0 gradi Kelvin?
Bellelli: questa domanda verte verso la filosofia. Il calore e' una forma di
energia posseduta dai corpi; quindi in senso stretto il vuoto non possiede veramente ne' calore
ne' temperatura, e non e' in grado di scambiare calore con altri corpi, anche se pue' essere
attraversato da radiazione infrarossa e microonde, che veicolano calore. Infatti un termos, che
può mantenere la temperatura del suo contenuto, e' fatto da un sottile involucro chiuso in vetro
al cui interno e' stato fatto il vuoto. Pero' proprio perche' il vuoto non puo' contenere calore, e'
formalmente corretto (ma poco sensato) dire che la sua temperatura e' 0 K.
Salve, nel sito dice che il fumarato rientra nel mitocondrio diventando
ossalacetato. Il libro dice che non ci sono carrier per l'ossalacetato. Come rientra allora il
fumarato?
Bellelli: il libro ha ragione. Nel citoplasma della cellula ci sono enzimi che
convertono fumarato in ossalacetato, ed è quest'ultimo ad essere trasportato nel mitocondrio.
Gli enzimi citoplasmatici catalizzano reazioni formalmente identiche a quelle mitocondriali ma
sono proteine diverse, codificati da geni diversi.
Buongiorno. Non capisco perché nel tampone bicarbonato anidride carbonica
la CO2 è pari alla concentrazione di acido e lo ione bicarbonato è pari a quella del sale
Bellelli: questo è spiegato nella lezione sui tamponi del sangue. In breve il
sale del tampone è il bicarbonato di sodio presente nel plasma. L'acido dovrebbe essere l'acido
carbonico (H2CO3) che però è presente in piccolissima quantità ed è in equilibrio con la CO2,
a causa della reazione CO2 + H2O <=> H2CO3; quindi si considera quest'ultima come acido.
Salve Professore, non capisco come una delle due CO2 prodotte dal ciclo di
Krebs derivi dall'acetilCoA; non derivano dall'ossalacetato entrambe?
Bellelli: una delle CO2 viene dall'acetile, l'altra dall'ossalato, ma questo non
si puo' facilmente spiegare a parole. Modifico la figura del ciclo di Krebs, vada a vederla sul sito.
Buonasera professore nella dimostrazione dell'idrolisi salina acida non mi riesce a tornare che H3O+
e' uguale a radice di Ki x Cs.
Bellelli: la reazione (ad esempio) di NH4Cl è: NH4Cl --> NH4+ + Cl- ; e poi
NH4+ + H2O <==> NH3 + H3O+. Scriviamo la legge di azione delle masse per la seconda (la
prima e' irreversibile) e otteniamo: Ki = [NH3] [H3O+] / [NH4+].
Approssimiamo [H3O+] = [NH3] (si formano nella stessa reazione) e [NH4+] = Cs (la reazione
ha un basso grado di dissociazione); otteniamo: Ki = [H3O+]^2 / Cs, da cui [H3O+] = radice Ki x Cs.
Buongiorno professore. In una pila a concentrazione perché nella cella a
concentrazione maggiore avviene la riduzione e non l'ossidazione?
Bellelli: la regola che lei enuncia non esiste. L'ossidazione avviene nella
semicella il cui potenziale è minore (piu' negativo o meno positivo) e la riduzione in quella in cui
il potenziale e' maggiore (piu' positivo o meno negativo).
Quindi per sapere dove avviene l'ossidazione e dove la riduzione occorre applicare l'equazione
di Nernst alle due semicelle e vedere quale delle due ha il potenziale minore.
Se la pila a concentrazione è fatta ad esempio con due semicelle a zinco l'equazione di Nernst
ci dice che la semicella con la maggiore concentrazione di ione Zn++ è quella che ha il
potenziale maggiore e quindi è quella in cui avviene la riduzione. Se invece facciamo una pila a
concentrazione di Cl2 / Cl- l'equazione di Nernst ci dice che la cella in cui è maggiore la
concentrazione dello ione Cl- è quella che ha il potenziale minore e quindi è quella in cui
avviene l'ossidazione. Provi a immaginare qualche pila a concentrazione e a scrivere le
equazioni di Nernst delle due semicelle per verificare.
Perchè il benzene nucleofilo si combina con il gruppo OH dando sostituzione
elettrofila? E perchè se si aggiunge il NH2 risulta meno basico di un'ammina (alifatica)?
Bellelli: questa domanda è molto confusa. I termini elettrofilo e nucleofilo si
applicano ai meccanismi delle reazioni organiche; quando lei dice che il benzene si combina col
gruppo OH a quale reazione sta pensando? La sintesi chimica del fenolo di norma non si fa a
partire dal benzene; la si fa a partire dall'acido benzensulfonico o da un alogenuro del benzene
come il clorobenzene. L'amina del benzene (anilina) e in generale tutte le amine aromatiche
sono meno basiche (hanno Kb più basse) delle corrispondenti amine alifatiche perché il
doppietto elettronico dell'azoto è parzialmente coinvolto nel sistema aromatico delocalizzato.
Buonasera professore volevo comunicarle che nell'autovalutazione n.3 c'è
un errore. Nell'es.7: il cloruro di ammonio dà luogo a idrolisi acida.
Bellelli: grazie, controllo subito e provvedo a correggere.
Buonasera professore non ho capito bene come calcolare la densità dell'aria alla temperatura di 298K e alla pressione di 1 atm
Bellelli: possiamo ragionare in vari modi. Io le suggerisco il seguente:
prendiamo un numero di Avogadro di molecole (una mole totale). Le frazioni molari sono:
O2=21%; N2=79%. Dunque il peso di una mole di aria risulta: 32x0,21 + 28x0,79 = 28,8 g.
Il volume molare di un gas perfetto a 1 atm, 298 K è 24,4 L; quindi la densità dell'aria risulta
28,8 g / 24,4 L = 1,18 g/L.
Nella spiegazione dell'isomeria per gli alcani menziona 3 tipi: costituzione,
posizione, conformazione. Non capisco la differenza tra i primi due.
Bellelli: lei ha studiato male e deve rivedere quella lezione perché le
isomerie nel caso degli alcani sono semplicemente elencate, mentre sono spiegate in dettaglio
più avanti nella stessa lezione, con tutti gli esempi necessari. Per l'isomeria di costituzione
l'esempio proposto è quello della coppia butano-isobutano; per l'isomeria di posizione l'esempio
proposto è quello della coppia 2metilpentano-3metilpentano (che sono entrambi alcani). Studi
bene la lezione fino in fondo e provi a riscrivere le formule degli esempi proposti. Se poi non è
chiaro mi faccia una domanda più precisa.
Prof. ma qual è il significato di acet- davanti ai vari composti? es. acetilcolina acetamide ecc.
Bellelli: il termine acet- indica un residuo o un derivato di acido acetico. Il significato
preciso dipende dalla forma che si da al termine: acetamide e' l'amide dell'acido acetico (trova
la formula nella lezione sulla chimica organica: CH3-CO-NH2).
Acetil- di solito indica una molecola di acido acetico legata ad un altro composto con legame
estere o amidico. Ad esempio l'acetilcolina e' l'estere della colina (un alcol) con l'acido acetico
(formula: CH3-CO-O-CH2-CH2-N+(CH3)3),
mentre la N-acetil glucosamina è una molecola di glucosamina alla quale e' legato un acido
acetico con legame amidico (questa formula e' troppo complicata per scriverla qui per intero;
la parte della molecola che le interessa e': CH3-CO-NH-R).
Buongiorno professore. Nel legame nella molecola di azoto N2 parla di
ibridazione sp. Ma il legame non dovrebbe essere possibile già senza ibridazione?
Bellelli: l'ibridazione dell'atomo nella molecola è sempre la più alta
compatibile con i legami pi greco che possono derivare soltanto da orbitali p non ibridizzati.
Quindi l'ibridazione di N in N2 è sp.
Buonasera Professore purtroppo non riesco proprio a capire i fenomeni
osmotici che si verificano nei vaso capillari lei ha parlato di osmosi inversa all'estremità
arteriosa del capillare.
Bellelli: il sangue contenuto nel capillare e' sottoposto a due tipi di pressione:
la pressione idrostatica dovuta alla spinta del cuore e la pressione osmotica dovuta alla
differenza di concentrazione dei soli soluti ad alto peso molecolare tra sangue e liquido
extracellulare. Le due pressioni hanno verso opposto: la pressione idrostatica spinge liquido
dal capillare verso il liquido extracellulare, la pressione colloido-osmotica attrae liquido dal
liquido extracellulare all'interno del capillare.
Il flusso netto di liquido è determinato dalla differenza tra le due pressioni: se la pressione
idrostatica è più grande della pressione colloido-osmotica il flusso netto di liquido sarà diretto
dall'interno del capillare verso l'esterno; in caso contrario avrà direzione opposta.
All'estremità arteriosa si verifica il primo caso (osmosi inversa); all'estremità venosa del
capillare si verifica il secondo caso.
Buongiorno prof. per la preparazione dell'esame esiste una lista delle formule
di struttura e non che dobbiamo conoscere?
Bellelli: La lista è data dalle formule presentate a lezione o presenti nel
materiale reso disponibile sul sito. Inoltre al link "Altro materiale didattico" è riportata una lista
di composti dei quali può essere richiesta la formula in sede di esame.
Come mai l'energia di legame ionico è maggiore di quella del legame covalente?
Bellelli: questa informazione non è vera: il legame ionico e quello covalente
hanno energie comparabili e, semmai l'energia di legame del legame covalente è spesso
maggiore di quella del legame ionico. Ad ogni modo la generalizzazione è difficile perché
dipende da quali molecole lei considera.
In che modo l'abbassamento crioscopico e l'innalzamento ebullioscopico sono
una diretta conseguenza dell'abbassamento della tensione di vapore?
Bellelli: premesso che la sua affermazione è pertinente alla soluzione di
solidi in liquidi e potrebbe non essere vera nel caso della soluzione di liquidi in liquidi, la
spiegazione è chiara dal diagramma di stato. In particolare, nel caso dell'innalzamento
ebullioscopico, la temperatura di ebollizione è quella temperatura alla quale la pressione di
vapore saturo della soluzione (ma in una soluzione di solidi in liquidi la pressione di vapore del
solvente nella soluzione, perché il soluto non passa in fase di vapore) uguaglia la pressione
atmosferica. Nella soluzione di un solido in un liquido, la pressione di vapore è minore della
pressione di vapore del solvente puro (legge di Raoult) e quindi è necessaria una maggiore
temperatura per far bollire la soluzione.
Come mai all'aumentare della pressione la temperatura di fusione dell acqua diminuisce?
Bellelli: L'acqua è un composto atipico, nel quale il solido ha minore densità
del liquido e infatti il ghiaccio galleggia sull'acqua. Questo comporta che la pressione fa
sciogliere il ghiaccio, perché convertendosi in acqua la sostanza occupa un minor volume.
Se la pressione è elevata occorre raffreddare di più per far gelare l'acqua, perché occorre
espandere il volume del sistema vincendo l'effetto della pressione.
Perché le diluizioni seriali rendono più potente un farmaco?
Bellelli: La sua affermazione non è vera e quindi la domanda non ha
risposta. Le diluizioni seriali diminuiscono l'effetto del farmaco fino ad annullarlo. Lei sta citando
l'ipotesi della medicina omeopatica, una teoria medica sviluppata tra la fine del 1700 e l'inizio
del 1800, ma successivamente dimostrata falsa. Nel materiale didattico riportato sul sito, a
proposito delle diluizioni seriali, si cita questa teoria ma si spiega chiaramente che è falsa e
completamente priva di basi scientifiche.
Perché alcune molecole di origine vegetale es. Alcaloidi tropanici quando
estratte in solventi alcolici si illuminano di rosso se esposte a luce UV?
Bellelli: lei non specifica il nome della molecola alla quale fa riferimento,
quindi la risposta è generica: si tratta di fenomeni di fluorescenza o fosforescenza. Il fotone UV
viene assorbito e promuove un elettrone da un orbitale di stato fondamentale ad un orbitale
di stato eccitato, con energia superiore. L'elettrone ritorna dallo stato eccitato a quello
fondamentale con emissione di energia, in parte sotto forma di calore, in parte sotto forma di
radiazione elettromagnetica. Poiché una parte dell'energia viene dissipata come calore, la
lunghezza d'onda della luce emessa è maggiore (=minore energia) di quella della luce UV usata
per popolare lo stato eccitato (legge di Stokes).
Prof. non mi è chiara la legge di Ostwald. Quanto va approfondito l’argomento ai fini dell’esame?
Bellelli: la legge di Ostwald è parte del programma e viene spiegata a
lezione e nel materiale sul sito, al quale la rimando. Bisogna conoscerla e saperla applicare
perché alcuni esercizi della prova scritta di esame potrebbero richiederla; inoltre nella prova
orale può essere richiesta la dimostrazione della formula di Ostwald a partire dalla legge di
azione delle masse. L'importanza della legge di Ostwald è che e permette di calcolare il grado
di dissociazione alfa.
Non ho ben capito riguardo ai parametri standard dell'emogas analisi: come
fanno ad eliminare gli effetti della compensazione del polmone?
Bellelli: diciamo prima di tutto che i parametri standard dovrebbero
eliminare non solo la compensazione ma qualunque contributo, anche patologico del polmone
e lasciare la sola componente metabolica (patologica o compensatoria).
I parametri standard sono misurati (dopo aver misurato i parametri "normali) equilibrando il
sangue con 40 mmHg di CO2 e 100 mmHg di O2 a 37°C. Questi sono i parametri respiratori
attesi in assenza di malattia o compenso polmonare: cioè quelli che si registrerebbero nel
paziente se il polmone funzionasse in modo "standard". Immaginiamo un esempio di acidosi
respiratoria acuta con pH=7.24, PCO2=65 mmHg, HCO3-=28 mM. Questo sangue portato a
condizioni standard avrà pH=7.4, PCO2=40 mmHg, HCO3-=24 mM cioè sarà riportato ai
valori normali dell'uomo sano perché l'alterazione è dovuta soltanto alla malattia polmonare
e corretta questa non resta nessuna componente metabolica.
Immaginiamo ora un esempio di acidosi respiratoria cronica con pH=7.36, PCO2=70 mmHg,
HCO3-=40 mM. Questo sangue portato a condizioni standard potrebbe presentare: pH=7.5,
PCO2=40 mmHg, HCO3-=32 mM. Questo sangue a condizioni standard non torna a pH=7.4
perché contiene un eccesso di bicarbonato prodotto dal compenso renale, che non viene
completamente eliminato con trasformazione in CO2 ed eliminazione in fase gassosa.
Il problema di parametri standard e che da soli non distinguono completamente tra il
compenso renale ed un'eventuale altra patologia metabolica e l'interpretazione diagnostica
richiede una grande esperienza specialistica.
Buonasera professore volevo chiederle esattamente cosa sia il valore A trovato nell'equazione di Arrhenius
Bellelli: il termine pre-esponenziale A nell'equazione di Arrhenius è un fattore
probabilistico che tiene conto del fatto che l'urto tra due molecole per essere efficace (cioè
per romper un legame chimico e produrre l'intermedio attivato) deve avvenire con una
opportuna geometria: deve cioè avvenire in modo che l'energia cinetica sia dissipata nella
distorsione del legame chimico che si deve rompere.
Buongiorno professore perché l'anidride carbonica totale nel sangue non segue la legge di Henry?
Bellelli: l'anidride carbonica totale nel sangue è data dalla somma di 3 componenti:
la CO2 (5%); il bicarbonato (90%); e i complessi con i gruppi aminici delle proteine (5%).
Di questi tre componenti soltanto la CO2 può passare in fase gassosa e raggiungere l'equilibrio
previsto dalla legge di Henry. Quindi la CO2 "come tale" segue la legge di Henry. Poiché
il bicarbonato e i carbamati non passano in fase gassosa, questi non possono seguire la legge di
Henry e di conseguenza neppure l'anidride carbonica totale può seguirla.
salve professore non ho ben capito la reazione di ordine zero degli enzimi.
In che modo la concentrazione non contribuisce alla velocità di reazione?
Bellelli: l'ordine zero è un ordine apparente. La reazione che produce il
prodotto è ES --> E + P ed è chiaramente monomolecolare e di primo ordine; quindi la sua
velocità è V=[ES] x k3. Però a stato stazionario la concentrazione di ES è costante perché ES
viene costantemente riformato dalla reazione E+S --> ES. Se [ES] è costante noi otteniamo
che V=costante x k3 che è un ordine zero.
Buongiorno prof. può spiegare come risolvere il primo esercizio: il grafico dell’autovalutazione 6?
Bellelli: non posso facilmente spiegarlo qui ma lo ho spiegato in aula e mi
auguro che lei fosse presente. Proverò a mettere una soluzione sul sito web.
Buonasera Professore, come mai il fruttosio ciclizzato assume la forma furanosica e non piranosica?
Bellelli: l'ultimo C della catena è molto mobile (ha elevata entropia) e la
reazione di ciclizzazione a carico del C6, tanto nel glucosio che nel fruttosio, avrebbe l'effetto
di ridurre l'entropia della molecola; per questo è sfavorita rispetto alla reazione a carico del C5.
Buonasera prof., non ho capito se anche il legame ionico ha un orbitale di
legame o se sia semplicemente un legame dovuto alle forze elettrostatiche tra ioni.
Bellelli: l'energia di ogni legame chimico ha una componente data dalla
formazione dell'orbitale di legame e una data dalla differenza di carica elettrostatica. Nel caso
del legame ionico il contributo dell'orbitale di legame è trascurabile, quindi si può dire che nel
legame ionico l'energia è data quasi completamente dall'attrazione elettrostatica tra ioni di
segno opposto. Puoi fare riferimento alla figura 4 della lezione sul legame chimico.
Buongiorno prof. non ho capito perche' l'entalpia che è calore scambiato tra
sistema e ambiente che per definizione dipende dal gradiente termico sia indipendente dalla
temperatura
Bellelli: il calore che un corpo può assorbire dipende dal gradiente termico
e dal calore specifico del corpo. Se il corpo è un sistema termodinamico capace di una
reazione chimica il calore che esso assorbe o cede ha oltre ad aumentarne la temperatura ha
effetto sulla reazione chimica, e la spinge verso i reagenti o verso i prodotti. Ovvero il calore
assorbito ha due effetti: riscalda il sistema e cambia la costante di equilibrio, promuovendo la
reazione diretta o l'inversa. Qualunque sia il gradiente di temperatura, la
condizione di equilibrio del sistema è limitata tra il 100% dei prodotti e il 100% dei reagenti:
anche se il gradiente termico fosse infinito ci sarebbe sempre un limite a quanto calore la
reazione puo' assorbire, limite che non c'è per il sistema in toto; la temperatura continua ad
aumentare ma non stimola ulteriore conversione di reagente in prodotto o viceversa perche'
non c'è più reagente o prodotto da trasformare. Considera un esempio banale:
A <==> B + 10 kcal/mole . Immagina che il tuo sistema termodinamico sia un recipiente
chiuso ma non isolato, contenente A e B in equilibrio tra loro a 20°C. Riscalda il recipiente
alla temperatura sufficiente a fargli assorbire 10 kcal/mole di B (quale temperatura sia
necessaria dipende dal calore specifico); a questo punto tutto B si sarà convertito in A.
Riscalda ora ulteriormente: a questo aumento di temperatura non corrisponde una ulteriore
conversione di B in A perché tutto B si era già convertito in A. Volendo essere più precisi:
l'aumento di temperatura causa una diminuzione della costante di equilibrio e tu non converti
tutto B in A; ti fermerai al 99% o al 99,9%; ma in ogni caso la reazione sarà quasi completa
e approssimera' asintoticamente il suo valore limite di 10 kcal/mole.
Torna a: Home page del corso; didattica; pagina iniziale.