1) Gli acidi grassi sono presenti nella dieta, principalmente sotto forma di trigliceridi e fosfogliceridi, e costituiscono la principale riserva energetica del nostro organismo, sotto forma di trigliceridi accumulati nelle cellule del tessuto adiposo.
2) I trigliceridi alimentari vengono digeriti a monogliceridi e acidi grassi dalla lipasi pancreatica e assorbiti sotto queste forme.
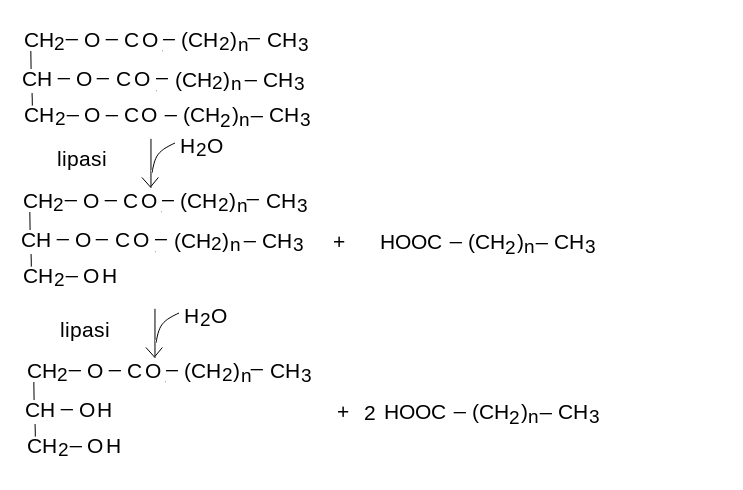
Nella cellula intestinale i trigliceridi vengono ricostituiti e rilasciati nel sangue sotto forma di chilomicroni. Il fegato rimuove i chilomicroni e libera i trigliceridi nel sangue sotto forma di lipoproteine a bassissima densita' (VLDL), che possono essere utilizzate da tutti i tessuti. I tessuti estraggono lipidi dalle VLDL e le trasformano in lipoproteine a densita' intermedia (IDL) e poi a bassa densita' (LDL). I tessuti, ed in particolare il tessuto adiposo possono utilizzare invece le lipoproteine ad alta densita' (HDL) per restituire al fegato il colesterolo.
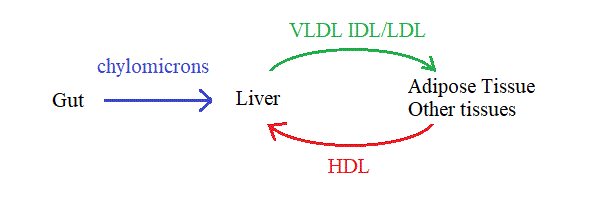
3) Le diverse lipoproteine differiscono tanto per il contenuto di lipidi, quanto per le parti proteiche (apolipoproteine):
I chilomicroni sono le lipoproteine con minima densita' (< 0.95 g/mL). Sono sintetizzati dagli enterociti utilizzando trigliceridi e colesterolo di origine alimentare. I componenti proteici sono A-I, A-II, B-48, C-I, C-II, C-III ed E: ciascuno e' codificato da un gene specifico ed ha una caratteristica sequenza aminoacidica.
Le lipoproteine a bassissima densita' (VLDL) contengono trigliceridi e colesterolo (o suoi esteri) legati ai componenti proteici B-100, C-I, C-II, C-III ed E. La loro densita' e' compresa tra 0.95 e 1.006 g/mL quindi nell'ultracentrifuga si raccolgono sopra il plasma (galleggiano).
Le lipoproteine a densita' intermedia (IDL) contengono trigliceridi e colesterolo (o suoi esteri) legati ai componenti proteici B-100,C-III ed E. La loro densita' e' compresa tra 1.006 e 1.019 g/mL. Originate dall'impoverimento delle VLDLs ed hanno la stessa funzione di quelle.
Le lipoproteine a bassa densita' (LDL) contengono trigliceridi e colesterolo (o suoi esteri) legati al componente proteico B-100. La loro densita' e' compresa tra 1.019 e 1.063 g/mL. Le LDL sono ricche di colesterolo e sono assorbite dalle cellule per endocitosi mediata da recettore. La vescicola endocitosica e' degradata mediante fusione coi lisosomi e l'apolipoproteina B-100 viene degradata.
Le lipoproteine ad alta densita' (HDL) trasportano il colesterolo ed i suoi esteridai tessuti al fegato, cioe' in direzione opposta alle altre lipoproteine; il fegato richiede grandi quantita' di colesterolo per la biosintesi degi sali bilari (colato e desossicolato). I loro componenti proteici sono anch'essi diversi e sono indicati come A-I, A-II, C-I, C-II, C-III, D ed E; la loro densita' e' 1.063-1.210 g/mL.
| Lipoproteina | contenuto lipidico | componenti proteici | densita' | funzione |
| chilomicroni | prevalentemente trigliceridi | A-I, A-II, B-48, C-I, C-II, C-III, E | < 0.95 g/mL | trasporto dei lipidi di origine alimentare dall'intestino al fegato |
| VLDL | trigliceridi e colesterolo | B-100, C-I, C-II, C-III, E | 0.95-1.006 g/mL | trasporto dei lipidi dal fegato ai tessuti |
| IDL | trigliceridi e colesterolo | B-100,C-III, E | 1.006-1.019 g/mL | trasporto dei lipidi dal fegato ai tessuti |
| LDL | trigliceridi e colesterolo | B-100 | 1.019-1.063 g/mL | trasporto dei lipidi dal fegato ai tessuti |
| HDL | prevalentemente colesterolo | A-I, A-II, C-I, C-II, C-III, D, E | 1.063-1.210 g/mL | trasporto del colesterolo dal tessuto adiposo al fegato per la biosintesi dei sali biliari |
Colesterolo "buono" e colesterolo "cattivo": le VLDL, IDL e LDL legano il colesterolo con bassa affinita' e possono facilmente rilasciarlo ai tessuti; se il colesterolo rilasciato da queste lipoproteine va ad infiltrare la parete dei vasi arteriosi vi puo' causare aterosclerosi. Le HDL legano il colesterolo con alta affinita' e possono addirittura estrarlo dai depositi tissutali; hanno quindi effetto protettivo nei confronti dell'aterosclerosi. Il contenuto di lipidi del sangue umano e' di norma di circa 150 mg/dL per i trigliceridi e di circa 200 mg/dL per il colesterolo; di questo circa il 40% e' legato alle HDL, il resto alle varie lipoproteine a bassa e bassissima densita'.
4) L'utilizzazione dei trigliceridi nella produzione di energia avviene mediante la β-ossidazione degli acidi grassi, una via metabolica mitocondriale. Il trasferimento degli acidi grassi dal citoplasma al mitocondrio e' complesso e richiede la biosintesi di un derivato particolare, l'acil-carnitina:
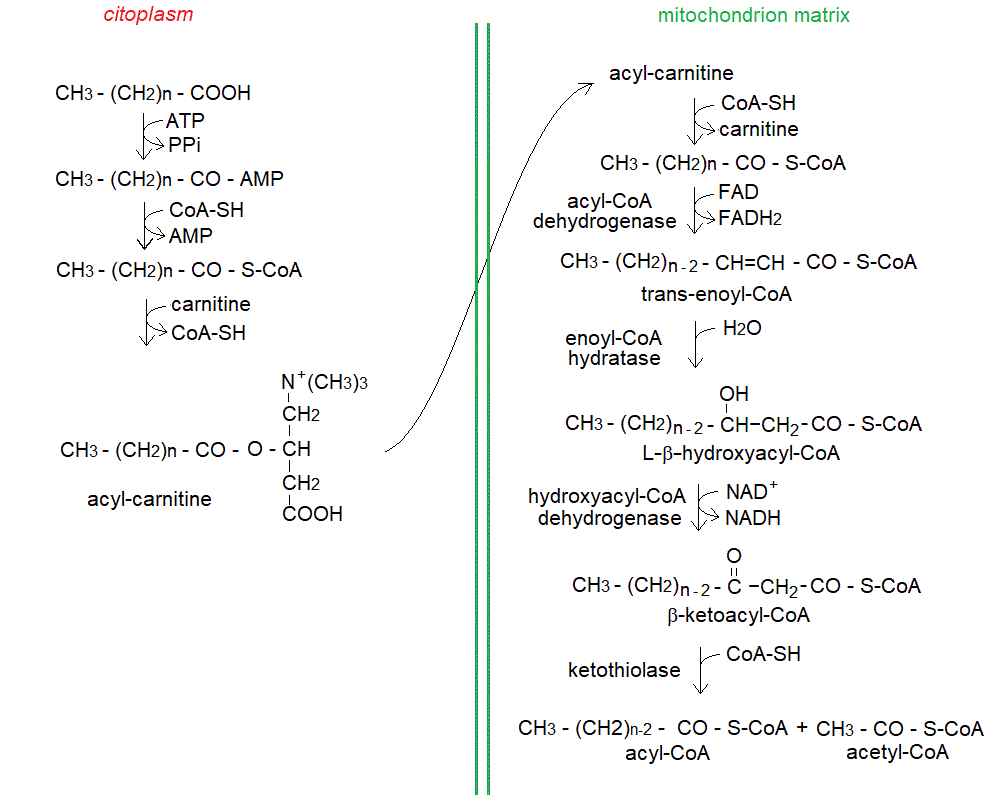
5) Gli enzimi della β-ossidazione sono presenti in varie isoforme nel mitocondrio, ciascuna specializzata per certe lunghezze della catena carboniosa: short chain acyl-Coa deydrogenase (LCAD), medium chain acyl-CoA dehydrogenase (MCAD), etc. e ciascuna di esse puo' essere affetta da difetti genetici. La carenza di MCAD e' una possibile causa di morte neonatale improvvisa.
6) Se l'acido grasso e' insaturo si possono verificare alcune condizioni che richiedono enzimi addizionali:
a) si forma un cis-β-enoil-CoA invece dell'isomero trans; una specifica isomerasi converte il cis-enoil-CoA in trans-enoil-CoA che è il substrato dell'idratasi;
b) si forma un di-enoil-CoA; in questo caso deve intervenire la di-enoil-CoA reduttasi che elimina il doppio legame non funzionale con consumo di NADH;
7) La β-ossidazione scompone l'acido grasso in un numero di molecole di acetil-CoA uguale alla meta' del numero degli atomi di carbonio. Di solito il numero di atomi di carbonio e' pari e la resa del processo e' di (n/2-1) FADH2 e altrettanti NADH. Se l'acido grasso ha un numero dispari di atomi di carbonio, alla fine del processo si ottiene una molecola di propionil-CoA, che deve anch'esso essere utilizzato. Il metabolismo del propionil-CoA e' il seguente:
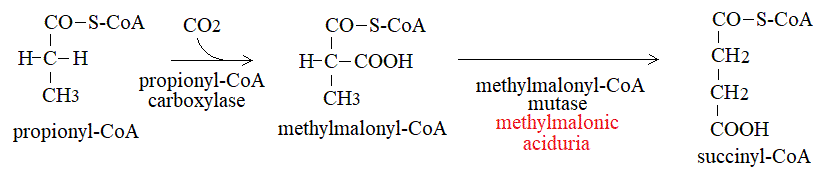
E' importante sottolineare che gli acidi grassi sono una fonte insignificante di propionil-CoA, mentre una quantita' piu' elevata di questo composto deriva dal metabolismo degli aminoacidi metionina, valina e isoleucina.
8) L'acetil-CoA derivante dalla β-ossidazione puo' essere utilizzato direttamente nel ciclo di Krebs; alternativamente il fegato può utilizzarlo per la biosintesi del colesterolo, o per la biosintesi dei corpi chetonici, che vengono poi rilasciati nel sangue. I corpi chetonici sono gli acidi acetoacetico e β-idrossibutanoico; inoltre e' un corpo chetonico l'acetone, che si produce per decarbossilazione spontanea dell'acetoacetato. Sono utilizzati per la produzione di energia da vari tessuti, in particolare dal muscolo scheletrico e cardiaco. L'acetone e' volatile, ed e' eliminato in parte con la respirazione, cui impartisce un odore caratteristico (alito acetonico).
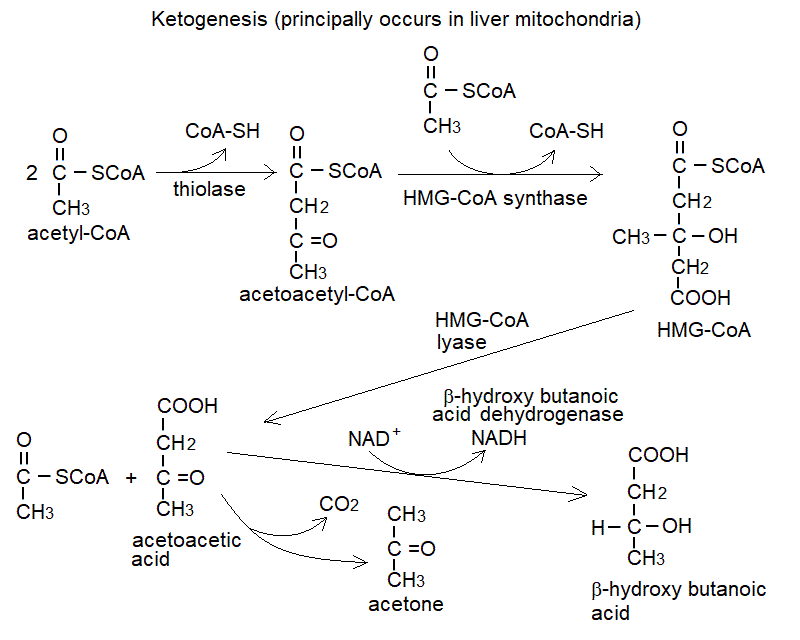
9) Nel diabete mellito di tipo I (dovuto a una ridotta o assente produzione di insulina) le cellule non possono assorbire il glucosio e ricorrono ad altre vie metaboliche per la loro produzione di energia. L'iperglicemia e' la conseguenza del mancato assorbimento di glucosio ma non e' il "danno" principale della malattia, ed ha invece un ruolo accessorio nella malattia. Il problema metabolico principale del diabete sta nel fatto che la produzione di piruvato e' ridotta per la riduzione della glicolisi cellulare. Il piruvato e' il principale componente dell'anaplerosi dell'ossalacetato mitocondriale e in carenza di piruvato il ciclo di Krebs e' rallentato. Questo comporta un aumento del metabolismo lipidico e un accumulo di corpi chetonici dovuto all'incompleta utilizzazione dell'acetil-CoA. I corpi chetonici rilasciati nel sangue causano una grave acidosi metabolica che e' la principale causa di morte per il diabetico di tipo I non correttamente trattato con l'insulina. Ovviamente, nel paziente il ciclo di Krebs funziona, seppure a un livello ridotto, grazie alle altre reazioni anaplerotiche; ma la regolazione del metabolismo e' gravemente alterata.