1) Le proteine vanno fisiologicamente incontro a processi di denaturazione o di modificazioni chimiche che ne compromettono la funzione (ad es. danni ossidativi). Per questo sono soggette a ricambio: ogni proteina ha una sua vita media al termine della quale viene degradata e scomposta in aminoacidi e questi sono utilizzati per sintetizzare nuove proteine. I meccanismi della degradazione e del ricambio sono diversi per le proteine extracellulari e intracellulari.
2) Dal punto di vista della loro biosintesi, proteine intracellulari vengono sintetizzate dai ribosomi citoplasmatici; svolgono la loro funzione nel citoplasma o nel nucleo; sono sintetizzate nello stesso modo anche le proteine mitocondriali e quelle dei perossisomi. Per contro le proteine di membrana o extracellulari sono sintetizzate dai ribosomi associati al Reticolo Endoplasmico Rugoso (RER). Queste proteine possiedono una sequenza aminoacidica segnale N-terminale che viene riconosciuta dal poro del reticolo endoplasmico e associa ad esso il ribosoma. Come risultato la catena polipeptidica nascente si forma nel lume del reticolo endoplasmico. Sono sintetizzati in questo modo anche gli enzimi lisosomiali.
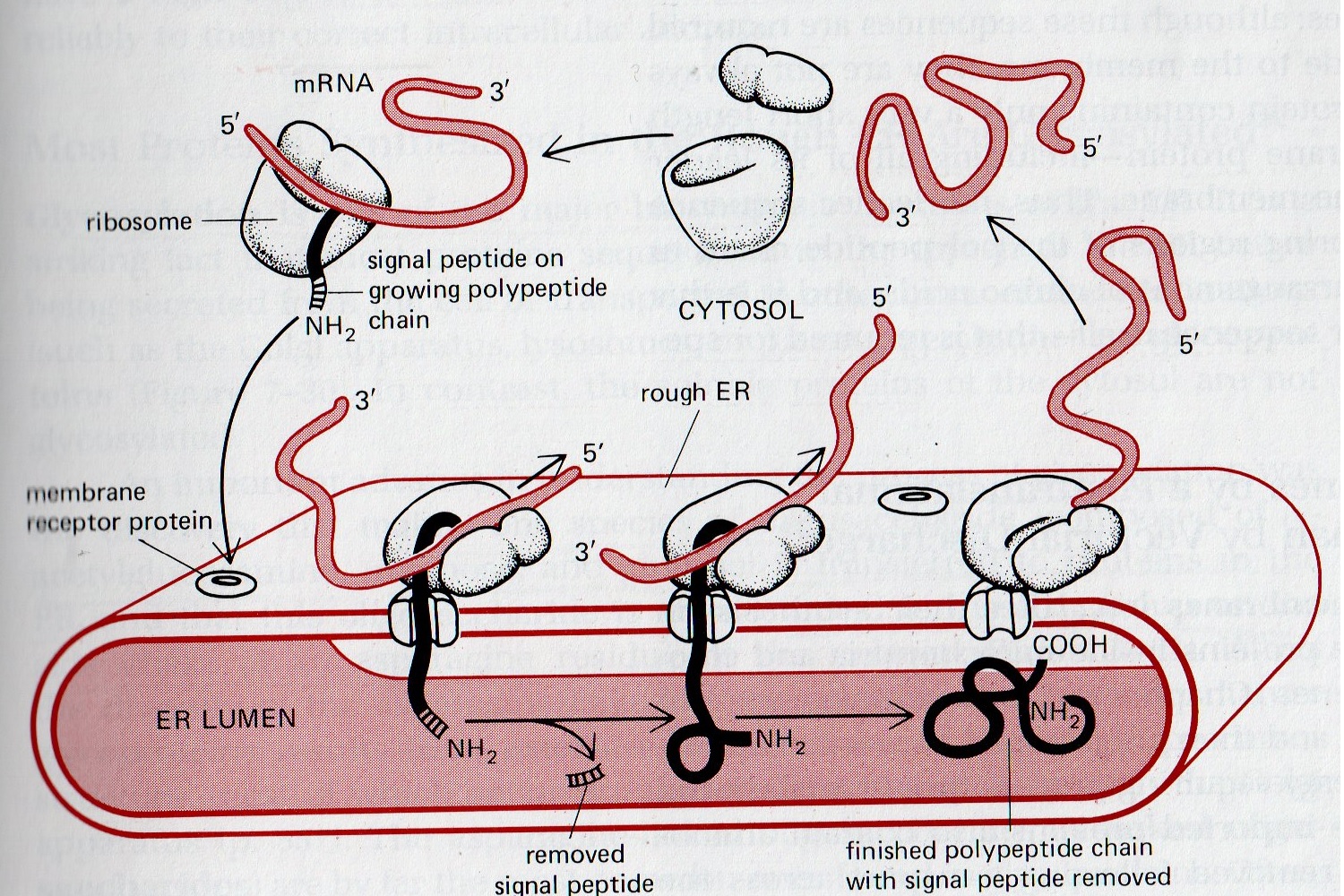
| sede della biosintesi | Proteine |
| ribosomi del citosol | citosoliche nucleari mitocondriali dei perossisomi |
| ribosomi del RER | della membrana cellulare della membrana del RE della membrana del Golgi enzimi lisosomiali secretorie |
| segnale | destinazione |
| sequenza KDEL (Lys-Asp-Glu-Leu) carbossi-terminale | lume del reticolo endoplasmico |
| sequenza diacidica (es. Asp-X-Glu) | membrana dell'apparato di Golgi |
| sequenza specifica NH-terminale | matrice mitocondriale |
| sequenza NLS (es. Pro2-Lys3-Arg-Lys-Val) | nucleo |
| sequenza PTS (es. Ser-Lys-Leu) | perossisomi |
| glicosilazione don mannosio-6P | lisosomi |
3) Le proteine destinate alla secrezione nell'ambiente extracellulare (o anche quelle destinate a svolgere la loro funzione nella membrana cellulare) presentano una sequenza aminoacidica "leader" all'estremita' amino terminale, che viene sintetizzata per prima. La sequenza leader viene riconosciuta da un poro proteico sulla superficie del reticolo endoplasmico e associa il ribosoma al reticolo gia' durante il processo di traduzione; di conseguenza la proteina viene sintetizzata e al tempo stesso secreta nel lume del reticolo endoplasmico (che diventa rugoso grazie all'associazione dei ribosomi). La sequenza leader puo' poi essere rimossa dopo la biosintesi. Il reticolo endoplasmico forma vescicole contenenti le proteine che migrano attraverso l'apparato di Golgi e successivamente da questo alla membrana cellulare dove la vescicola si fonde e riversa il suo contenuto all'esterno della cellula. Pertanto la secrezione di proteine richiede un traffico intracellulare di vescicole lipidiche, dal RE o dal Golgi alla membrana. Se sono richieste modificazioni post-traduzionali (ad es. glicosilazione) queste vengono in genere effettuate nell'apparato di Golgi. Esempi di proteine secrete sono numerosi: le proteine del sangue, incluse le immunoglobuline; ormoni proteici; enzimi digestivi; collageno e altre proteine della matrice del tessuto connettivo; etc.
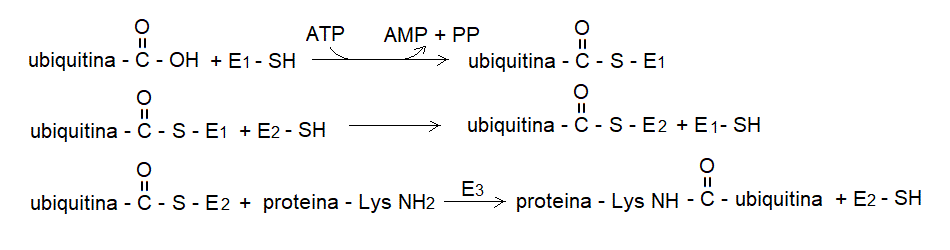
4) La principale via di degradazione delle proteine intracellulari passa per il meccanismo della coniugazione con l'ubiquitina. L'ubiquitina e' una piccola proteina (76 residui aminoacidici) altamente conservata. La coniugazione delle proteine intracellulari danneggiate con l'ubiquitina avviene in tre stadi e richiede ATP; utilizza tre enzimi (E1: ubiquitin-activating enzyme; E2: ubiquiting-conjugating enzyme; E3: ubiquitin ligase):

5) Le proteine extracellulari sono soggette anch'esse a turnover e in genere il turnover avviene mediante ricaptazione selettiva da parte di varie cellule, mediante processi di endocitosi, pinocitosi o endocitosi mediata da recettore. In questo modo la proteina entra nella cellula all'interno di una vescicola (endosoma primario) che va incontro a fusione con altre vescicole, sempre derivate dal reticolo endoplasmico, contenenti gli enzimi digestivi (lisosomi). La digestione della proteina extracellulare avviene quindi nell'endosoma secondario.
6) L'endocitosi mediata da recettore: un caso particolare di traffico proteico si osserva per quelle proteine che possiedono uno specifico recettore sulla membrana della cellula bersaglio; ad esempio la transferrina, principale proteina di trasporto del ferro. In questi casi la proteina si combina con il suo recettore di membrana e induce un cambiamento conformazionale che si riflette sulla struttura della porzione citoplasmatica del recettore; spesso il cambiamento conformazionale e' mediato dalla dimerizzazione del recettore che e' monomerico in assenza della proteina segnale e dimerico in sua presenza. A causa del cambiamento conformazionale il recettore acquisisce la capacita' di combinarsi con una specifica proteina citoplasmatica, la clatrina. La diffusione laterale dei recettori combinati con la clatrina, e la capacità di autoaggregarsi della clatrina porta al raccogliersi dei recettori in una regione definita della membrana, la fossetta rivestita (di clatrina, coated pit), che si trasforma per endocitosi in una vescicola rivestita (coated vesicle).
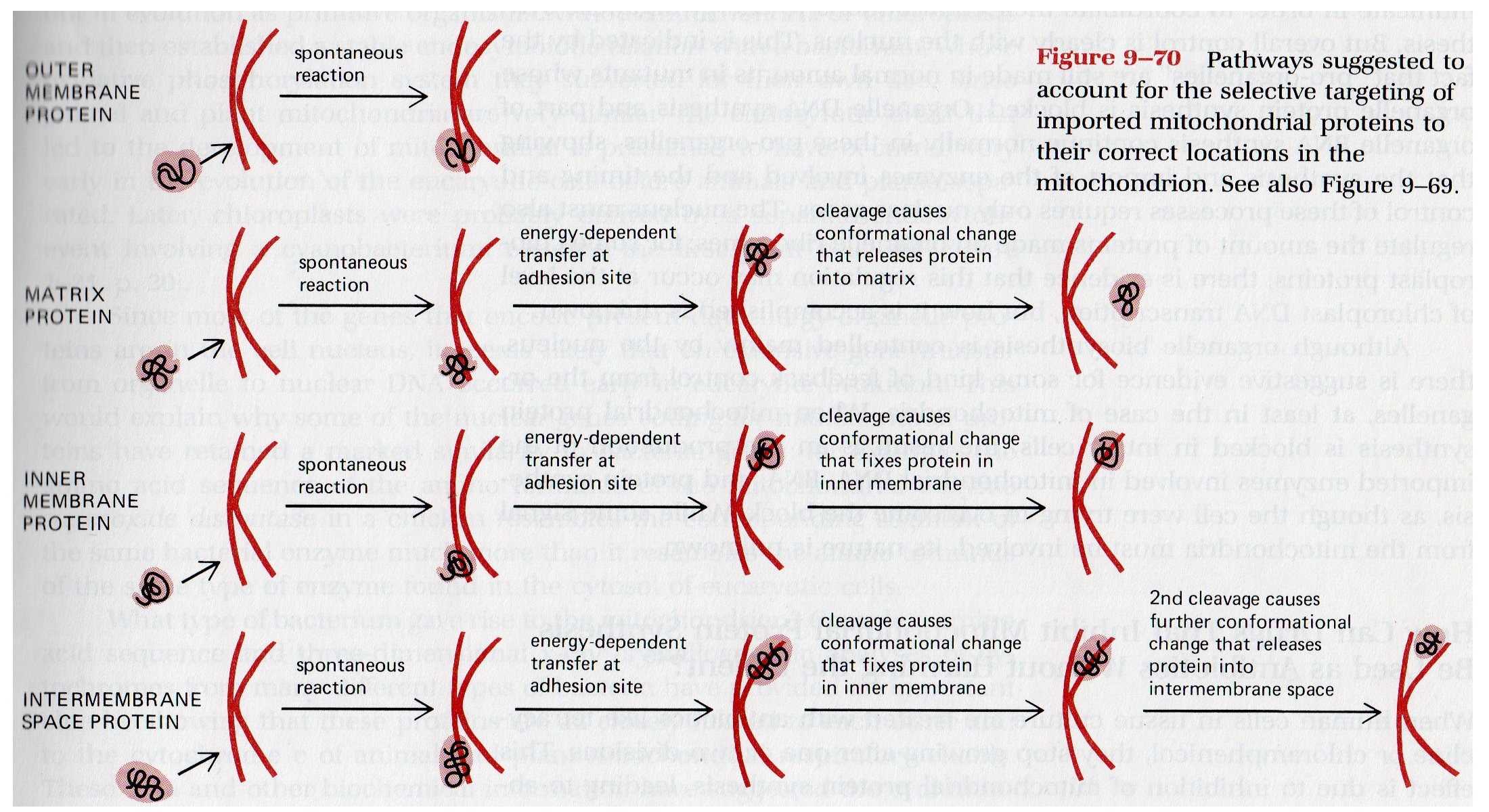
7) Il mitocondrio (e il cloroplasto) costituisce un caso particolare: soltanto la minoranza delle proteine mitocondriali e' codificata dal genoma mitocondriale: la maggior parte viene sintetizzata dalla cellula nel citoplasma ed importata nel mitocondrio con meccanismi che richiedono ATP e che differiscono a seconda della destinazione finale della proteina importata.