| |
ENZIMOLOGIA 2: ENZIMI A DUE SUBSTRATI E LORO INIBITORI
1. La maggioranza degli enzimi utilizza due substrati. I meccanismi di reazione sono piuttosto variabili. Si deve considerare una dicotomia fondamentale:
a) e' necessaria la formazione di un complesso ternario, dell'enzima con i suoi due substrati; questo e' il caso, ad esempio delle sintetasi che uniscono due molecole di substrati per formare una molecola di prodotto. Ad esempio la citrato sintetasi (CS) catalizza la reazione:
acetil-CoA + ossalacetato + CS --> CS-acetilCoA-ossalacetato --> citrato + CoA-SH + CS
b) non e' necessaria la formazione del complesso ternario: il primo substrato modifica in qualche modo l'enzima e l'enzima modificato puo' trasformare il secondo substrato. Questo e' il meccanismo di azione delle aminotransferasi e di molte transferasi, nonche' di molte ossido-reduttasi. Ad esempio la tioredossina reduttasi (TR) catalizza la reazione:
TRox + NADPH --> TRred + NADP+
TRred + Trxox --> TRox + Trxred
In alcuni casi puo' essere difficile stabilire quale sia il meccanismo, ma in linea di principio la differenza dovrebbe essere chiara. Spesso, quando devono essere rilasciati piu' prodotti, l'ordine di rilascio dei prodotti puo' fornire indicazioni importanti sul meccanismo.
2. Per un trattamento analitico del funzionamento della TR e dei suoi inibitori si puo' vedere questo articolo. Un trattamento semplificato e' il seguente.
Gli enzimi che richiedono due substrati possono essere studiati mantenendo costante la concentrazione di uno dei due e variando quella dell'altro; in un esperimento di questo tipo, la velocita' della reazione dipende iperbolicamente dalla concentrazione del substrato variabile e risponde pienamente all'equazione di Michaelis e Menten. Pero' in queste condizioni i parametri KM e kcat non sono costanti termodinamiche e non hanno lo stesso significato di quelli del modello originale. Per illustrare questo punto consideriamo un meccanismo catalitico estremamente semplificato come quello riportato sopra per la tioredossina reduttasi (TR), e assumiamo (semplicisticamente) che le due reazioni siano bimolecolari, di secondo ordine e irreversibili; la semireazione di riduzione dell'enzima abbia costante cinetica k1 e quella di ossidazione k2.
A stato stazionario si avra':
[TRox] [NADPH] k1 = [TRred] [Trxox] k2
La velocita' della reazione catalizzata puo' essere definita dal consumo di substrato o dalla formazione di prodotto; ad esempio, se seguiamo l'ossidazione del NADPH:
v = -d[NADPH]/dt = [TRox] [NADPH] k1
Per determinare l'equazione cinetica dello stato stazionario dobbiamo derivare il polinomio di legame rispetto ad una specie usata come riferimento, ad es. TRox:
TRred = TRox [NADPH] k1 / [Trxox] k2
[TRtot] = [TRox] (1 + [NADPH] k1 / [Trxox] k2)
Pertanto la velocita' della reazione catalizzata risulta:
V = [TRtot] [NADPH] k1 [Trxox] k2 / ([Trxox] k2 + [NADPH] k1)
La velocita' massima si ottiene a concentrazione molto elevata del substrato variabile (ad es. Trxox), mentre viene mantenuta costante la concentrazione dell'altro substrato (NADPH). Se si immagina di assegnare a [Trxox] un valore infinito, tutti i termini che non contengono questo termine risultano trasvurabili e si ottiene:
Vmax, [NADPH]=cost. = [TRtot] [NADPH] k1
La KM e' definita come la concentrazione del substrato variabile necessaria affinche' V = 1/2 Vmax:
[TRtot] [NADPH] k1 KM Trx, [NADPH]=cost k2 / (KM Trx, [NADPH]=cost k2 + [NADPH] k1) = [TRtot] [NADPH] k1 / 2
KM Trx, [NADPH]=cost = [NADPH] k1 / k2
In questo esperimento KM e Vmax non sono parametri termodinamici perche' contengono una variabile ([NADPH]) e se l'esperimento viene condotto a concentrazioni diverse di NADPH si otterranno valori diversi di KM e Vmax:
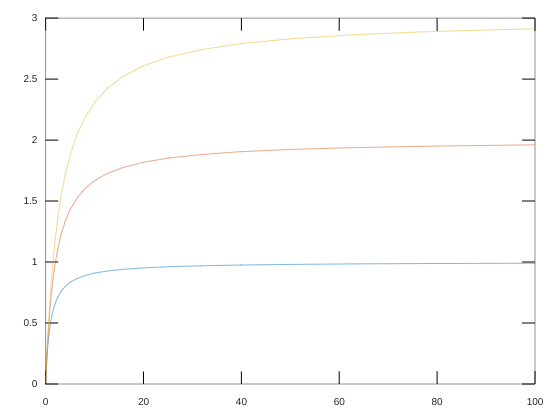 E' interessante esplicitare che, come si vede dal grafico, la costante di specificita' in questo meccanismo e' un parametro termodinamico in quanto risulta dipendente soltanto da costanti e non contiene termini variabili:
E' interessante esplicitare che, come si vede dal grafico, la costante di specificita' in questo meccanismo e' un parametro termodinamico in quanto risulta dipendente soltanto da costanti e non contiene termini variabili:
kcat, [NADPH]=cost. / KM Trx, [NADPH]=cost. = k2
|
|
