1. Il metabolismo dell'uomo richiede l'ossigeno. Il metabolismo basale e' nell'ordine delle 1600 kcal al giorno, e aumenta se l'individuo svolge compiti gravosi. Il fabbisogno calorico viene soddisfatto col metabolismo degli alimenti e questo e' ossidativo e richiede l'ossigeno che noi otteniamo attraverso la respirazione. L'equivalente energetico dell'ossigeno e' di circa 117 kcal /mole e pertanto il nostro fabbisogno giornaliero di ossigeno e' di circa 15 moli al giorno, corrispondenti a circa 10 mMoli/min.
2. L'ossigeno e' trasportato ai tessuti dal sangue; pero' essendo un gas poco solubile, il contenuto di ossigeno del sangue deve essere incrementato. L'organismo ottiene questo risultato producendo la proteina emoglobina (Hb), molto solubile e capace di combinarsi reversibilmente con l'ossigeno. L'emoglobina e' contenuta nei globuli rossi e nel sangue intero la sua concentrazione e' di circa 14 g/dL, corrispondenti a 9 mMoli/L di siti di legame per l'ossigeno. In questo modo il nostro sangue puo' raggiungere un contenuto di ossigeno pari a 20 volumi % (20 mL di gas misurato a condizioni standard in 100 mL di sangue) o 9 mMoli/L. Di questo notevole quantitativo di ossigeno, circa il 2% e' presente nella forma del gas liberamente disciolto, mentre il 98% e' presente nella forma di complesso con l'emoglobina.
3. La portata circolatoria dell'uomo e' di circa 5 L/min. (valore medio, ampie oscillazioni sono possibili); per soddisfare il fabbisogno di ossigeno ogni litro di sangue deve cedere ai tessuti 2 mMoli del gas e questo si ottiene desaturando parzialmente l'emoglobina da un valore di saturazione del 98% nel sangue arterioso ad uno del 75% del sangue venoso:
4. Il problema del trasporto dell'ossigeno pero' presenta un ulteriore grado di complessita': non solo il sangue deve rilasciare 2 mMoli del gas per litro, ma deve anche farlo a una concentrazione locale nel capillare tissutale piuttosto elevata, necessaria per mantenere il gradiente necessario ad assicurare la velocita' di diffusione dal capillare ai mitocondri (legge di Fick della diffusione: V = d C / l). In pratica e' conveniente esprimere la concentrazione di ossigeno, attraverso la legge di Henry, come pressione parziale del gas che sarebbe in equilibrio col gas disciolto. I valori sono: PO2 nell'aria alveolare = 100-110 mmHg; PO2 nel sangue arterioso = 95 mmHg; PO2 nel sangue venoso = 40 mmHg. La differenza tra la PO2 nel sangue arterioso e venoso e' molto piccola, circa 2,5 volte. Ricordiamo da una lezione precedente che una proteina monomerica richiede una diminuzione di concentrazione del ligando di 9 volte per passare da un grado di saturazione del 75% a uno del 25%.
5. L'emoglobina assolve al suo ruolo fisiologico con una funzione di dissociazione dell'ossigeno che non e' iperbolica ma sigmoide; sulla scala logaritmica della PO2 con una sigmoide molto piu' ripida (in rosso) di quella di una proteina monomerica con la stessa P50 (in blu):
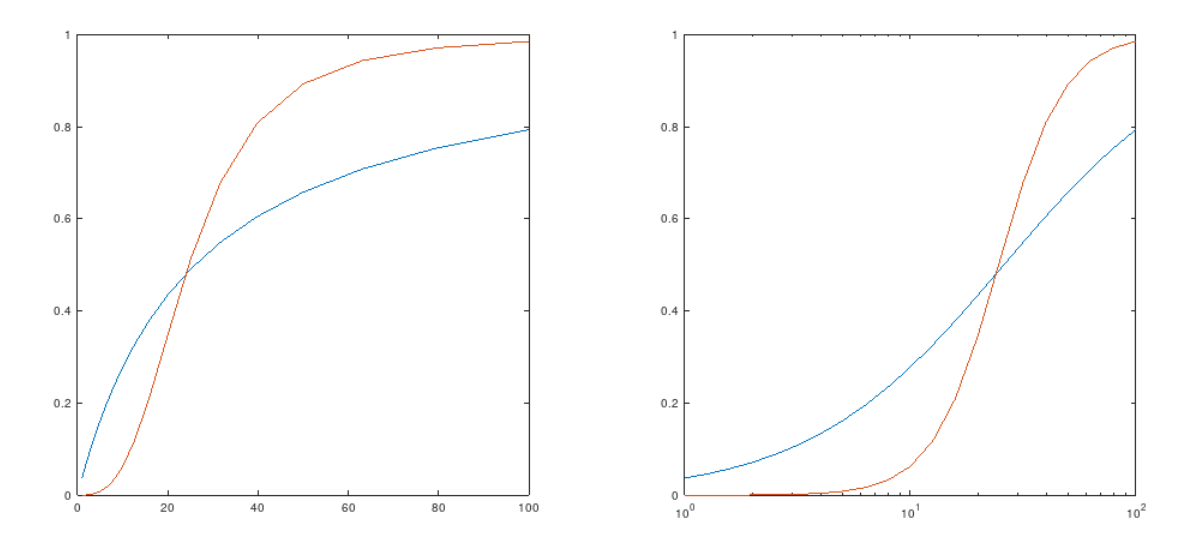
6. La curva sigmoide di dissociazione dell'ossigeno, scoperta da vari studiosi nel primo decennio del '900 si spiega grazie alle interazioni omotropiche: l'emoglobina e' infatti una molecola tetramerica, formata da 2 subunita' proteiche chiamate α e 2 subunita' β, diverse per la sequenza aminoacidica. Il tetramero completamente desossigenato lega la prima molecola di ossigeno con una affinita' molto piu' bassa di quanto il tetramero contenente tre molecole di ossigeno lega la quarta. Questo comportamento identifica le interazioni omotropiche ed e' chiamato cooperativo.
7. Le subunita' α e β sono due piccole proteine molto simili tra loro e alla mioglobina, di circa 150 residui aminoacidici ciascuna, e con struttura formata da 8 α-eliche nominate con le lettere da A ad H. Ciascuna delle subunita' contiene un gruppo eme che costituisce il sito di legame dell'ossigeno. Dal punto di vista strutturale le interfacce tra le subunita' del tetramero sono tutte isologhe e simmetriche e il tetramero e' convenientemente descritto come un omodimero di eterodimeri. L'eterodimero di base, nel quale il tetramero dissocia se posto in soluzione a concentrazioni nell'ordine del μM o inferiori, e' costituito da una subunita' α e una β; l'interfaccia tra le due e' costituita delle eliche B, G e H di ciascuna subunita', con i contatti αB-βH; αG-βG; αH-βB. Due eterodimeri αβ, chiamati α1β1 e α2β2 si uniscono per formare il tetramero, attraverso contatti tra l'elica C e il tratto interelica FG: α1C-β2FG e α1FG-β2C coi loro simmetrici α2C-β1FG e α2FG-β1C .
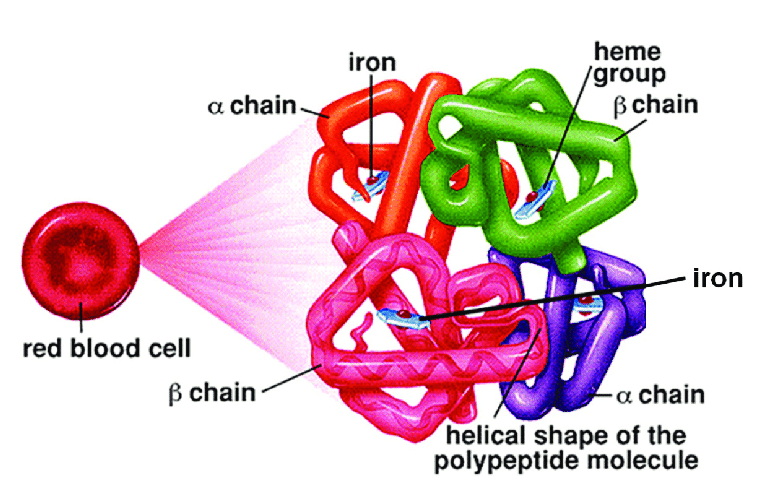
8. Le relazioni tra struttura e funzione nel'emoglobina sono state studiate in grande dettaglio e in pratica la migliore spiegazione disponibile e' data dal modello allosterico proposto da Monod, Wyman e Changeux nel 1965 e dalle sue successive varianti. La migliore interpretazione strutturale della cooperativita', perfettamente compatibile con il modello allosterico, fu proposta dal premio Nobel M.F. Perutz nel 1970.
9. Il legame dell'ossigeno avviene sull'atomo di ferro del gruppo eme. L'eme e' un anello aromatico tetrapirrolico (protoporfirina IX) che coordina al suo centro uno ione ferro:
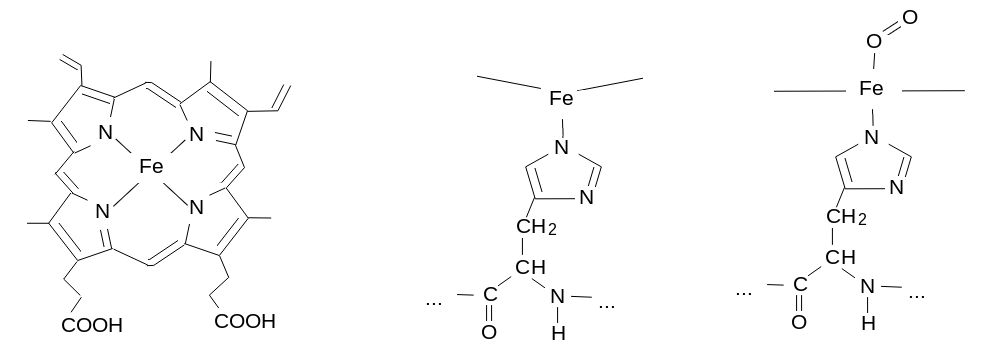
a) il Fe in assenza dell'ossigeno e' paramagnetico e ad alto spin (4/2) ed ha un diametro ionico troppo largo per entrare tra i 4 N della porfirina;
b) lo stato pentacoordinato con geometria piramidale a base quadrata forza il metallo al centro geometrico dei suoi ligandi, che ovviamente non coincide col centro della base della piramide;
c) l'istidina prossimale tira il Fe verso di se, quindi in direzione opposta al piano dell'eme.
Quando l'ossigeno o un altro ligando si combina con l'eme occupando la sesta posizione di coordinazione del ferro i primi due fattori vengono annullati perche' il Fe diventa diamagnetico e a basso spin (0), riducendo il suo diametro e perche' la geometria di coordinazione diventa bipiramidale ed il centro geometrico coincide col piano dell'eme.
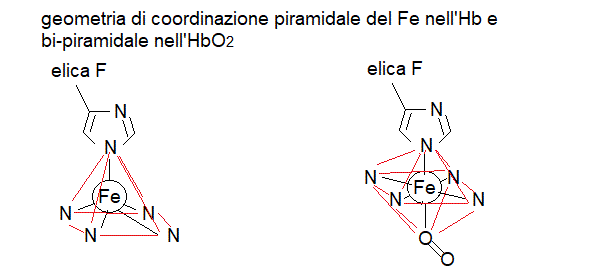
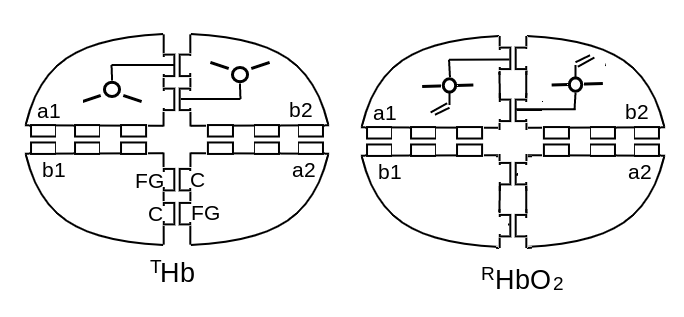
10. Il tetramero dell'emoglobina e' stabile in due conformazioni quaternarie che differiscono per l'angolo formato dai due dimeri tra loro. Le due conformazioni presentano sottili differenze a livello dell'interfaccia α1β2. e l'angolo formato dagli assi dei due dimeri α1β1 e α2β2 differisce di circa 15o.
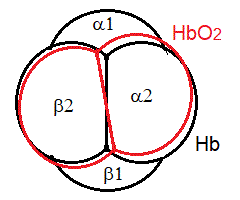
11. Se le 4 subunita' sono tutte ossigenate l'orientamento spaziale e la conformazione quaternaria preferita, come determinata dalla conformazione dell'interfaccia α1β2, e' con grandissima prevalenza quella caratteristica dell'HbO2; se invece le 4 subunita' sono tutte desossigenate la configurazione quaternaria largamente preferita e' quella caratteristica dell'Hb. Pero' le due conformazioni quaternarie devono essere considerate come isomeri sterici l'una dell'altra e sono tra loro in equilibrio a prescindere dalla presenza o assenza di ossigeno. Inoltre l'interfaccia α1β2 non consente configurazioni quaternarie intermedie; pertanto se le subunita' sono in parte ossigenate e in parte desossigenate il tetramero oscillera' tra le due possibili configurazioni quaternarie, preferendo ora l'una ora l'altra.
12. In che modo la situazione sopra descritta determina la cooperativitita' del legame con l'ossigeno? La spiegazione della relazione tra struttura e funzione di questo sistema e' fornita dal modello allosterico.
Il modello allosterico, proposto da Monod, Wyman e Changeux nel 1965 postula che l'emoglobina sia stabile in due conformazioni quaternarie distinte, entrambe simmetriche, chiamate T e R. Le due conformazioni sono tra loro in equilibrio in qualunque stato di ossigenazione e la costante di equilibrio e' chiamata L; ad es. in assenza di ossigeno si ha:
Lo stato R si combina con l'ossigeno con la costante KR e lo stato T con la costante KT definite come costanti di dissociazione:
KT = [Ti-1] [O2/ [Ti]
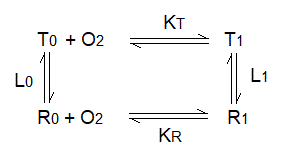
13. In aggiunta alle interazioni omotropiche, dell'ossigeno con se stesso, l'emoglobina media anche interazioni eterotropiche: piccole molecole o ioni contenuti nel globulo rosso si combinano preferenzialmente con uno dei due stati (in pratica sempre con lo stato T), cambiando il valore di L0 (e in molti casi anche quello di KT). Gli effettori eterotropici principali sono: gli ioni idrogeno, gli ioni cloruro, l'anidride carbonica e il 2,3 difosfoglicerato. L'effetto di queste sostanze su L0 e' molto grande: a seconda della loro concentrazione possono aumentare L0 fino a 1.000 volte. Corrispondentemente la P50 dell'emoglobina che a pH=9 e in assenza di effettori e' di circa 1 mmHg a 25oC aumenta fino a circa 15 mmHg a pH=7,4 in presenza di cloruro e DPG alle concentrazioni fisiologiche. Inoltre la combinazione dell'ossigeno con l'emoglobina e' una reazione esotermica per circa 12 kcal/mole e questo porta la P50 a circa 26 mmHg in condizioni fisiologiche e a 37oC.